Специфическая противоопухолевая активность Флараксина в эксперименте на мышах С57В16 с меланомой В-16
Киевский НИИ Фармакологии и Токсикологии АМН Украины
Ниже представлен эксперимент на мишах по лечению меланомы
Также прочтите - лечение рака шейки матки
Начало работы: 09.1990. Окончание: 12.1990.
Препарат Флараксин был получен для проведения испытаний из Киевского НИИ фармакологии и токсикологии МЗ УССР в стерильных флаконах в виде порошка подлежащего растворению перед введением животным. Перевивка меланомы В-16 осуществлялась путем подкожного введения в правую заднюю лапку мыши 2х105 клеток опухоли в среде 199/в объеме 0,1 мл.
Рост опухоли оценивали путем ежедневного замера диаметров ее в трех взаимно перпендикулярных областях, с последующим расчетом объема опухоли как произведение трех ее замеров. Динамика опухоли по группам экспериментальных животных представлена в таблице 1 и на рис.1.
Флараксин вводили ежедневно начиная с 5 сут. После перевивки, в течение 10 дней (8 инъекций, внутримышечно в дозах 7,7; 15,0 и 30,0 массы тела соответственно 1/40, 1/20 и 1/10 ЛД50), суммарно соответственно 60,0; 120,0; 240,0. Препарат вводили в мышцу симметричной конечности мыши. Всего, таким образом, было 4 экспериментальных группы животных – контроль (мыши с меланомой В-16, но без введения препарата) и 3 опытные (получавшие соответственно 3 дозы препарата), по 8 животных в группе итого 32 мыши в группе. С учетом морфологических исследований всего использовано 90 мышей с меланомой В-16 и 10 интактных мышей С57ВL.
Животных для морфологического гистологического исследования быстро умерщвляли на 3, 7, 10, 14 сутки от начала исследования. На каждый срок - по 5-8 животных в двух повторениях. Обработку материалов для гистологических исследований проводили в основном по общепринятой методике (А.И. Кононский, 1976, А.Ф. Киселева и соавт., 1983) со следующими модификациями: фиксацию материала производили не в формалине, а в жидкости Карнуа (абс. Спирт : хлороформ : ледяная уксусная кислота - 6:3:1), которая является более щадящей для нежной ткани меланомы, легко проникает в толщу ткани, быстро осаждает белки, препятствует диффузии отдельных соединений в фиксатор; окраску производили гематоксилином Караччи, который адекватен в случае прокрашивания пигментных веществ. Остальные этапы проводили по классической методике.
При микроскопировании гистологических препаратов, наряду с качественным морфологическим описанием, рассчитывали индекс повреждения (ИП) по Г.А. Лавниковой и соавт. (1978) в итоге изучение 2 тыс. клеток в каждом стекле как объективный количественный тест для оценки степени терапевтического метаморфоза, по формуле:
ИП=((Пк-По)/Пк)х100,
где По - средний объем паренхимы в опытной группе, Пк – средний объем паренхимы в контрольной группе. По Г.А. Лавниковой, с помощью ИП можно объективно сравнивать эффективность схем лечения. Другим количественным критерием эффективности лечения опухолей является митотический индекс (МИ, определяемый как частное от деления числа делящихся-во всех фазах митоза) к неделящемся клеткам (в %) на 2 тыс. просчитанных клеток и характеризующей степени сохранения жизнеспособности опухолевой ткани и ее полиферативную активность (Н.М. Смирнов и соавт., 1973; Н.К. Дъяконова, В.А. Довбищенко, 1976 и др.).
В качестве современного критерия состояния иммунной системы использовали содержание тимусного сывороточного фактора (ТСФ) и тимозиноподобную сывороточную активность (ТСА), оцениваемые в тесте J.F. Bach (1973). Метод основан на способности гормонов вилочковой железы восстанавливать чувствительность спонтанно розеткообразующих клеток селезенки взрослых тимэктомированных мышей к антитимоцитарной сыворотке (АТС). АТС получали, вводя двукратно кроликам (с двухнедельным интервалом) по 5х108 живых тимоцитов мышей. Затем в цитотоксическом тесте определяли активность АТС и использовали ее при титрах 1:50 – 1:100. Высокомолекулярный ингибитор ТСФ удаляли из сыворотки путем ультрафильтрации (фильтр фирмы Amicon). В реакции использовали по 0,1 мл цельной и серийно разбавленной средой 199 сыворотки.
Среда 199 служила также контролем. Селезенку брали у мышей через 10-14 дней после тимэктомии. Клетки извлекали путем разволокнения ткани препаровальными иглами в среде 199, фильтровали через капроновое сито и двукратно отмывали центрифугированием при 400g. Осадок ресуспендировали в среде до концентрации 4х107 клеток/мл и взвесь в объеме 0,1 мл добавляли в пробирке с сывороткой и средой 199. Содержимое пробирок перемешивали пипетированием и инкубировали на 60 мин. При 370*С после инкубации во все пробирки вносили по 0,1 мл АТС и комплемента морской свинки в разведении 1:1. Смесь инкубировали еще 30 мин. При 370С. Затем к смеси дабавляли по 0,1 мл суспензии эритроцитов барана 10х107 клеток/мл, перемешивали, центрифугировали при 250g и инкубировали 60 мин. При 4-80С. осадок ресуспендировали 5 мин., вращая пробирки со скоростью 10 об/мин подсчет розеток производили в камере Горяева. За розетку принимали лимфоцит присоединивший 4 и более эритроцитов. Титром ТСФ считали последнее разведение сыворотки, вызывающий 50 % редукцию числа розеткообразующих клеток по отношению к контролю. Результаты выражали в виде log2 титра.
Полученные результаты представлены в таблицах и на рисунках.
Установлено, что введение флараксина в дозе 30 мг/кг не оказало выраженного тормозящего влияния на скорость роста меланомы В-16. Более того, наблюдалась даже некоторая тенденция сокращения средней продолжительности мышей, подвергшихся лечению в этой дозе (см. табл.1, рис.1). Этот результат можно рассматривать как первое проявление токсичности препарата, которое свидетельствует о нецелесообразности увеличения разовой дозы препарата.
При снижении разовой дозы до 15 мг/кг наблюдали эффект торможения опухолевого роста на 18е и 20е сутки после перевивки. Однако в целом эффект препарата в этих условиях был минимальным.
Со снижением дозы препарата до 7,5 мг/кг в сутки торможение опухолевого роста оказалось более выраженным, приблизившись к 50%, а средняя продолжительность жизни мышей с меланомой В-16 возросла на 3,1 в сут. Этот эффект препарата свидетельствует о перспективности дальнейших исследований с его применением и, в частности, о необходимости анализа механизмов его специфической активности.
В морфологических исследованиях было установлено макроскопически, что в подопытных группах мышей плотность кусочков опухолевой ткани при фиксации была значительно ниже, чем в контроле: ткань была рыхлой, а цвет был красно-коричневым, в отличие от черно-коричневой и более плотной ткани опухоли из контрольной группы. Макроскопические различия между контрольными и опытными образцами не вызывали сомнений, тогда как между подопытными группами выраженных отличий не отмечено.
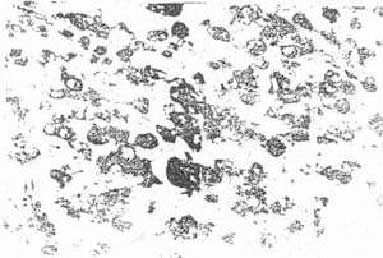
Патогистологически в препаратах интактной меланомы В-16 определялись преимущественно мелкие клетки овальной формы; встречаются также округлые и удлиненные клетки. Ядра чаще гиперхромны. Меланоциты располагаются сплошными полями, плотно прилегают друг к другу (рис.2). Некротические и некробиотические участки в интактных опухолях встречаются редко. Характерно для гистологического строения меланомы В-16 большое количество сосудов, испещряющих всю площадь среза. Зоны пролифорацин располагаются мозаично. В таких зонах митотический индекс достигает 3,9 %. Число клеток в состоянии некроза и некробиоза незначительно (менее 2 %),поэтому показателем индекса повреждения (ИП) в контроле можно пренебречь.
Результаты эксперимента.
Эффект флараксина в дозе 30 мг/кг.
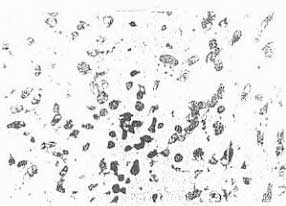
В препаратах опухолей мышей этой группы на 3 и 7 сут отмечалось повышенное, по сравнению с контролем, число клеток в поле зрения, находящихся в состоянии дистрофии и вакуолизации (рис.3). Однако обширные поля некроза встречались редко. Дегенеративно измеренные клетки, явления пикноза, кариорексиса и кариолизиса редки. Индекс повреждения ткани составил 38,7%, т.е. был невысоким, тем более, что полиферация клеток сохраняется на уровне контроля. Высокая репродуктивная способность опухолевой ткани на 3 и 7 сут лечения послужила причиной восстановления жизнеспособности и сохранения потенции к росту меланомы в условиях введения препарата в дозе 30 мг/кг массы мышей. На 14 сут ИП начал снижаться, составив 32,3%. В этот срок наблюдения характерен некробиоз отдельных клеток с образованием их теней, межклеточный сток.
Иллюстрации к отчету.
 |
 |
 |
 |
 |
Эффект флараксина в дозе 15,0 мг/кг.
Патологические и морфологические изменения в этой группе животных на всем протяжении исследования более выражены, чем при введении флараксина в дозе 30 мг/кг. В препаратах отмечались явления лимфоидно-гистиоцитарной инфильтрации опухолевой ткани, очаговая клеточная пролиферация стромы.
Паренхима в отдельных участках подвергалась частичной резорбции. ИП был существенно выше, чем в предыдущей группе, и равнялся 57,9%, т.е. был достаточно значительным. Однако пролиферативная активность ткани опухоли, составляющая потенциал ее ре-популяции и дальнейшего роста, снизилась незначительно. В препаратах, особенно на 10 – 14 сут., отмечено характерное возрастание фиброзной ткани, не наблюдавшееся в контроле в предыдущей, опытной группе животных. Суммируя результаты, полученные в этой серии экспериментов, мы можем отметить, что появление таких признаков, как лимфоидно-гистиоцитарная инфильтрация, пролиферация стромы и разрастание фиброзной ткани свидетельствует об активизации механизмов противоопухолевой резистентности организма под влиянием введения препарата в суточной дозе 15,0 мг/кг. Однако сохранение потенциала пролиферации, а также недостаточность деструкции ткани опухоли, выявившееся в этих экспериментах, свидетельствуют либо о неоптимальных условиях применения флараксина, либо о необходимости его комбинирования с другими противоопухолевыми воздействиями.
Эффект флараксина в дозе 7,5 мг/кг.
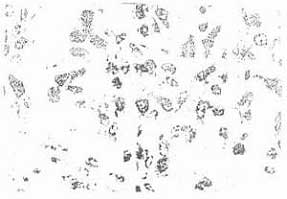
Патогистологические изменения в ткани опухоли в этой серии экспериментов выражены в еще большей степени, чем в предыдущей серии. В препаратах определялась активная лимфоидно-гистиоцитарная инфильтрация, а также пролиферация клеточных элементов стромы. Часто встречаются участки резорбции паренхимы опухоли. На 10е 14е сут характерны разрастания соединительной ткани, между фрагментами которой видны участки рассасывания опухолевой ткани и отдельные островки меланоцитов. Наблюдались также мелкие (по 10-12 клеток) участки опухолевой ткани, ограниченные мышечными волокнами (рис.4). Индекс повреждения (ИП) в этой серии экспериментов был наиболее высоким – 68,9%, характеризуя глубину изменений в опухолевой ткани. Однако пролиферативная активность клеток опухоли сохранена, что свидетельствует о высокой вероятности возобновления опухолевого роста.
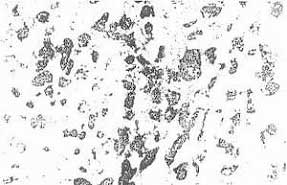
Можно констатировать определенные закономерные изменения состояния пигмента меланина в цитоплазме клеток опухоли, возникшие под влиянием лечения. В контрольных препаратах меланин определяется в виде своего рода «запыленности» цитоплазмы либо в форме полиморфных гранул зерен, глыбок. Количество пигмента в различных клетках колеблется от фоновых значений («запыленность») до значительного, заполняющего всю клетку (рис.5). В подопытных группах (15,0 и 30,0 мг/кг) мы не обнаружили достоверных количественных отличий в содержании пигмента в клетках опухоли; в каждом препарате встречались клетки с различной концентрацией пигмента. В группе введения флараксина (7,5 мг/кг), при всем сходстве с изменениями, описанными выше, создается впечатление, что насыщенность клеток опухоли меланином в целом ниже, чем в других подопытных группах (рис.6), а в особенности уменьшается количество меланинсодержащих клеток. Для препаратов из всех подопытных групп характерно неравномерное распределение пигментсодержащих клеток по площади среза.
Характер дозовой зависимости эффекта флараксина наводит на мысль о том, что механизм его противоопухолевого действия своеобразен и существенно отличается от эффекта классических препаратов (алкилирующих агентов). Изучение механизма действия препарата представляет самостоятельный интерес и может оказаться полезным в плане совершенствования методики его применения с целью получения более высокого противоопухолевого эффекта. В частности, представляет интерес изучение влияния препарата на биосинтез ДНК в клетках опухоли, на иммунологические механизмы. Некоторые результаты влияния флараксина на иммунную систему представлены ниже.
Результаты исследования динамики титра ТСФ, а также количества клеток в тимусе мышей и массы тимуса в процессе лечения мышей с меланомой В-16 представлены в таблицах 2, 3, 4.
Установлено, что у интактных мышей С57ВL нормальные значения log2 титра ТСФ составили 5,0±0,15 (n=36), а масса тимуса – 51,2 ± 2,16 мг (n=44). Под влиянием опухолевого процесса титр ТСФ закономерно снижается, вплоть до терминальной стадии, когда отмечено даже некоторое его повышение. Масса тимуса, как и количество клеток в нем, также резко снижается.
| Доза флараксина, мг/кг | До начала введения флараксина | Сроки после начала лечения, сут | |||
|---|---|---|---|---|---|
| 3 сут | 7 сут | 10 сут | 14 сут | ||
| 30 | 3,6±0,16x | 2,7±0,22x | 2,78±0,19x | 3,0±0,24x | 3,16±0,27x |
| 15 | --------- | 3,0±0,17x | 3,1±0,20x | 3,3±0,17x | 4,22±0,29x |
| 7,5 | --------- | 3,5±0,15x | 3,85±0,18x | 3,3±0,17x | 4,05±0,31x |
Примечание к Табл.2: ТСФ у интактных мышей составляет 5,0± 0,15x Р<0,05 по сравнению с нормой.
| Доза флараксина, мг/кг | Сроки после начала лечения, сут | |||
|---|---|---|---|---|
| До начала лечения | 7 сут | 10 сут | 14 сут | |
| Контроль | 14,8±3,87 | 6,34±0,11 | 2,67±0,23 | 0,37±0,11 |
| 30 | 12,5±3,16 | 4,08±0,56 | 2,26±0,37 | 0,42±0,09 |
| 15 | --------- | 4,57±0,23 | 3,86±0,23 | 0,74±0,46 |
| 7,5 | --------- | 4,22±0,35 | 4,31±0,42 | 1,21±0,38 |
| Доза флараксина, мг/кг | Сроки после начала лечения, сут | |||
|---|---|---|---|---|
| До начала лечения | 7 сут | 10 сут | 14 сут | |
| Контроль | 15,5±2,58 | 11,3±1,23 | 9,02±1,33 | 6,37±0,97 |
| 30 | - | 9,24±1,19 | 7,25±1,24 | 5,66±0,88 |
| 7,5 | - | 13,06±2,2 | 10,55±1,87 | 11,77±1,36 |
Введение флараксина в дозах 15,0 и 30,0 мг/кг не оказало существенного влияния на эти показатели. Более того, можно говорить о некотором углублении опухолевого иммунодефицита под влиянием флараксина. Тот же препарат в дозе 7,5 мг/кг , в отличии от этих данных, оказывал умеренно выраженное стимулирующее действие на иммунологические показатели (см. таблицы). Таким образом, и эти данные свидетельствуют о своеобразии механизма противоопухолевого действия флараксина. Если алкилирующие препараты, а также другие классические цитостатики одновременно выступают как мощные иммунодепресанты, то флараксин в наиболее эффективной дозе иммунодепресивным действием не обладает, а в дозах, вызывающих некоторое угнетение иммунных механизмов, практически не оказывает тормозящего влияния на рост опухоли.
Резюмируя полученные данные, полагаем необходимым подчеркнуть, что противоопухолевый эффект флараксина умерен и что, ориентируясь на эти данные, нельзя расчитывать на полное излечение меланомы с помощью этого препарата. С другой стороны, своеобразие механизма действия флараксина позволяет предполагать, что он является полезным компонентом комбинированной и комплексной терапии меланобластомы.
Целесообразно продолжить анализ механизма противоопухолевого действия флараксина, обратив особое внимание на его влияние на нуклоиновый обмен (синтез ДНК в опухолевых нормальных клетках), а также на эндокринную регуляциию, в особенности на функцию коры надпочечников. Есть косвенные данные, позволяющие предполагать, что флараксин оказывает умеренное ингибирующее влияние на продукцию глюкокортикоидов, которая при опухолевом процессе обычно усилена. Возможно, что эта сторона действия флараксина (которую еще следует подтвердить экспериментально) вносит вклад в его противоопухолевай эффект.
Таким образом, проведенные эксперименты свидетельствуют о целесообразности клинического изучения эффективности флараксина при меланобластомах.
д-р.м.н., проф. -В.А.Барабой,
к.м.н. - В.А.Зинченко,
к.м.н. - С.В.Мартыненко.
Дата 28 января 1992 года
Литература:
- Дьяконова Н.К., Довбищенко В.А. Патогенез рака шейки матки. // Второй съезд патологоанатомов УССР.-1976.-С.141-148.
- Киселева А.Ф., Житников А.Я., Ейсевич Л.В., Медвецкий Е.Б., Хильченко Е.А. Морфофункциональные методы исследования в норме и при патологии. //Киев, Здоров`я, 1983.-168с.
- Лавникова Г.А., Гош Т.Е., Талалаева А.В., Кобозева С.А., Червонная Л.В. Патогистологический метод количественной оценки степени лучевого повреждения опухоли. // Мед.радиол.,1978.-т.23, №3.-С.6-8.
- Кононский А.И. Гистохимия. // Вища школа, 1976.-с.280.
- Смирнов Н.И., Симбирцева Л.П., Снешко Л.И. Морфологические изменения при раке прямой кишки. // Вопр.онкол., 1973- т.19, №6.- С.45-57.
- Bach J. F., Dardenne M., Bach M.A. Demonstration of a circulating thymic hormone in mouse and in man. // Transplant.Proc., 1973-v.1, № 1.-P.99-104.

