Отчет по изучению фармакологического вещества «Флараксин» на предмет клинического применения как противоопухолевого средства
Киевский НИИ Фармакологии и Токсикологии
Этап 1991 г.
Ограниченная клиническая апробация. Доклиническое изучение «флараксина». Разработка нормативно-технической документации.
Зам. Директора по научной работе
Док-р.м.н., профессор - Ю.И.Губский
Руководители темы:
Член-корр. АН Украины, профессор - И.С.Чекман
Док-р мед.наук – Ю.Н.Максимов
Ответственные исполнители:
Канд.мед.наук, ст.н.с. – Т.И.Григрьева
Канд.мед.наук, ст.н.с. – И.А.Кулик
Список исполнителей
- (1; 2; 3; 4.2; 4.5; 6) – к.м.н., ст.н.с. Григорьева Т.И.
- (1; 2; 3; 4.2; 4.3; 4.5; 6) – д.м.н. Максимов Ю.Н.
- (4.1) – к.м.н., ст.н.с. Кулик И.А., к.ф.н., ст.н.с Горюшко А.Г.
- (4.2) – к.м.н. Коваленко В.И.
- (4.3) – к.м..н., ст.н.с. Аркадьев В.Г., к.м.н., ст.н.с. Салихов А.А.
- (4.4) – зав.лаб., д.м.н., проф. – Губский Ю.И., к.б.н. ст.н.с. Левицкий Е.Л.
- (4.5) – к.м.н., н.с. Богданович В.С., к.м.н. ст.н.с. Кулик И.А.
- (4.6) – д.б.н. Жила В.А., мл.н.с. Михайлов С.А., мл.н.с. Олексеенко С.И.
- (4.7) – ст.н.с. Герасимчук Т.В., к.ф.н. Ковальчук Т.В., ст.хим.инж. Медведовский А.А.
В работе также приняли участие:
- Аспиранты – Волошенюк Т.Г., Матюшкин В.А.
- Инженеры – Грачев А.В., Саченко Л.Г., Шнурко-Табакова Э.В.
- Ст.лаборанты – Захарова Н.С., Соломенная Н.П.
- Лаборанты – Павленко С.А., Каташинская Е.В., Шумар С.А., Лянная Н.Б.
- Препараторы – Бутенко Н.Б., Зятькова Л.А., Василенко Л.В., Куценко И.И.
Список принятых сокращений
- ФАВ – физиологически активные вещества
- ЧСА – человеческий сывороточный альбумин
- ПОЛ – перекисное окисление липидов
- У – объем распределения, л/кг
- С1 – клиренс, л/ч
- T1/2аб – период полуабсорбции, ч
- T1/2эл – период полуэлиминации, ч
- S – площадь под кривой «концентрация-время», мг.ч/л
Реферат
1 книга отчета: 114 стр., 1 том 114 стр., 25 табл., 37 источников
Токсичность (острая и хроническая), кумуляция, иммунная система, фармакокинетика «флараксина».
Проведено изучение фармакологических свойств вещества «флараксин» в эксперименте.
Использованы фармакологические, токсикологические, биохимические, физико-химические и др.методы исследования.
Установлено, что в условиях in vitro и in vivo «Флараксин» обладает выраженными антиоксидантными свойствами. Флараксин является малокумуирующим веществом, не оказывает неблагоприятного влияния на состояние гуморального звена иммунитета.
Определены фармакокинетические параметры, обнаружено, что Флараксин наименее активно поступает в почки и печень, наиболее в кожу, слизистую оболочку тонкого кишечника и в глаза.
Разработан проект Временной Фармакологической Статьи (ВФС).
Проведены клинические испытания 1 и 2 фазы по лечению меланобластом.
Содержание
- Аналитический обзор
- Обоснование выбранного направления
- Материал и методы исследования
- Экспериментальные исследования
- Физико-химические свойства Флараксина
- Кумулятивные свойства Флараксина и острая токсичность вещества-основы (ВО)
- Изучение влияния Флараксина на иммунологическую реактивность
- Исследование антиоксидантных свойств Флараксина и активности аминотрансфераз в крови больных, пролеченных Флараксином
- Поиск средств лечения отравлений, вызванных передозировкой Флараксина
- Фармакокинетические параметры Флараксина
- Проект ВФС, лабораторный регламент на производство Флараксина
- Клинические исследования
- Выводы
- Список использованных источников
1. Аналитический обзор
В доступной литературе имеется ограниченное количество публикаций, свидетельствующих о наличии у полифенолов противоопухолевой активности (1, 2, 3) и высокой токсичности.
Проведенные в 1990 г. В КНИИФТ исследования (4) показали, что Флараксин (состоящий из вещества-основы ВО и содержащей йод соли) обладает умеренной токсичностью и определенной противоопухолевой способностью (в опытах в культуре тканей). Это свидетельствует о необходимости дальнейшего изучения Флараксина.
2. Обоснование выбранного направления
В 1990 г. Были осуществлены эксперименты по изучению острой и хронической токсичности Флараксина, специфической активности и др. Установлено, что вещество тормозит более, чем на 50% рост меланомы.
В-16 (опыты на культуре ткани и на мышах) в терапевтических дозах (5-10 мг/кг в сутки) не оказывает неблагоприятного влияния на функцию ЦНС, сердечно-сосудистую систему ССС, периферическую кровь, кроветворение и др.
Все эти эксперименты послужили обоснованием для разрешения Фармакологической комиссии МЗ Украины проведения клинических испытаний.
Исследования 1991 г. Были направлены на изучение кумулятивных свойств, фармакокинетических параметров Флараксина, его влияния на гуморальное звено иммунитета, разработку ВФС и др. (в рамках требований Фармакологической комиссии МЗ Украины). Начаты клинические испытания Флараксина.
3. Материалы и Методы
Опыты проведены на собаках, крысах линии Вистар, белых мышах, а также осуществлены исследования сыворотки крови больных, пролеченных Флараксином.
Описание методов исследования будет приведено в соответствующих разделах отчета.
4. Экспериментальные исследования
a. Физико-химические свойства Флараксина.
В работе использовали порошки Циклофосфана, Проспидина, Флараксина (лиофилизированной формы), Вещество-основа ВО, лецитин-стандарт (10% раствор в спирте), общие липиды эритроцитов (10% раствор в спирте), Цитохром-С (Fе 0,35%, Англия), стабильный радикал трифенил-вердазил, человеческий сывороточный альбумин. В качестве растворителя брали воду для инъекций. Спектры поглощения растворов записывали на спектрофотометре «Shimadzu MPC-5000» (Япония), ИК-спектры, флуоресценции на спектрофлуориметре «Hitachi MPF-4» (Япония). Липосомы готовили по методике (5) в средах 20 мМ трис-НСl, 0,1m NaСl (рН 7,4). Ультразвуковую обработку проводили на диспергаторах УЗДН-2 (22 кГц, 10мин) и MSE (Англия, 40кГц, 20 мин) с последующим центрифугированием 15 мин при 8x103 об/мин-1. Размеры липосом (100-300 нм) измеряли с помощью спектрофотометра оптического смещения "Malwern" (Англия), рассеянный свет аргонового лазера (λ=488 нм) регистрировали под углом 90o в гомодинном режиме. Микровязкость липосом из общих липидов эритроцитов измеряли с помощью несимметричного полиметинового красителя 4501у по методике (6)
Кинетика взаимодействия Флараксина, ВО и ЧСА.
ЧСА – человеческий сывороточный альбумин, ВО – вещество-основа Флараксина.
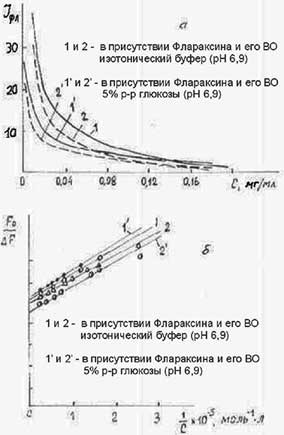
Информацию о кинетике взаимодействия исследуемых физиологически активного вещества (ФАВ) с ЧСА можно получить, используя метод тушения его флуорес-ценции. Нами было проведено спектро-флуориметрическое титрование растворов ЧСА (С=0,25 мг/мл) растворами ФАВ. На Рис.4.1а приведены зависимости, отражающие изменение интенсивности флуоресценции ЧСА на длинах волн 330нм и 305нм (λв=280 нм) с возрастанием концентрации Флараксина (1) и ВО (2) в изотоническом буфере и в растворе 5% глюкозы.
Как можно видеть, эффективность тушения флуоресценции веществом-основой ВО Флараксина больше, чем самим Флараксином. На Рис.4.1.(б) показаны графики в координатах Скетчарда F0/ΔF=f(1/c) (7), а в Табл.4.1 - оцененные величины констант тушения Kq (λ 330нм и 305нм).
Как следует из полученных результатов эксперимента, близкие значения Kq для разных длин волн, а также порядок констант (более низкие значения констант, чем для наносекундной динамики, характерной для внутри-глобулярных белков (8) свидетельст-вуют о влиянии окружения (вязкость среды, размеры и заряд тушителя) на процесс взаимодействия ФАВ с ЧСА. При этом замена изотонического буфера на 5% глюкозу приводило к ингибированию процесса тушения в случае Флараксина, величина Kq уменьшается на порядок, в то время как для вещества-основы Флараксина - Kq уменьшается в ~ 1,5 раза.
 |
| Вещество | Kq, [моль-1•сек-1•л] | |
|---|---|---|
| - | Изотонический буфер | 5% глюкоза |
| Флараксин | ||
| λфл 330 нм | (4,1±0,1)•105 | (4.2)•104 |
| λфл 305 нм | (3,0±0,1)•105 | - |
| Вещество-основа Флараксина | ||
| λфл 330 нм | (5,6±0,2)•105 | (3,65)•105 |
| λфл 305 нм | (6,6±0,2)•105) | - |
Т.е. система Флараксин - ЧСА, характеризующаяся более быстрым обменом протонов, сильнее реагирует на ассоциированную Н-связями среду 5% глюкозы (контролируемый диффузией процесс), чем система вещество-основа Флараксина - ЧСА, характеризующаяся более медленным протонным обменом, наличием прочных межмолекулярных Н-связей /9/.
Таким образом, проведенные исследования показали, что взаимодействие ЧСА с Флараксином протекает более медленно, чем с его веществом-основой, применение в качестве растворителя 5% глюкозы еще более ингибирует взаимодействие ЧСА с Флараксином.
Энзимотропное действие Флараксина и противоопухолевых препаратов
Предварительные исследования взаимодействия «Цитохрома-С» с «Флараксином» указывали на возможность образования межмолекулярных комплексов (10). Как известно (11), «Цитохром-С» представляет сложную ферментативную систему, включающую в себя кофермент-комплекс железа с протопорфиринами, связанный с белковым окружением ковалентными связями по серу содержащим функциональным группам.
В настоящей работе методами флуоресценции и спектрофотометрии изучено взаимодействие «Флараксина», вещества-основы Флараксина (ВО), «Циклофосфана» и «Проспидина» с белковыми структурами «Цитохрома-С» и его протогемом.
Флуориметрия
Спектры флуоресценции «Цитохрома-С» изучали в изотоническом буфере и в растворе 5% глюкозы. В спектре флуоресценции «Цитохрома-С» (концентрация С=10-4 моль/л, λ=286 нм) наблюдаются полосы, обусловленные флуоресценцией тирозиновых (λ=300 нм) и триптофановых (λфл=350 нм) остатков, а также малоинтенсивная длинноволновая компонента λфл=450 нм, характерная для триплетного свечения триптофана (8).
Нами было проведено флуориметрическое титрование раствора «Цитохрома-С» с «Флараксином» и ВО, «Проспидином» и «Циклофосфаном». Введение в раствор «Флараксина» и ВО сопровождалось изменениями в спектре флуоресценции «Цитохрома-С», тогда как «Проспидин» и «Циклофосфан» не влияли на его спектр. На Рис. 4.2. приведены зависимости, отражающие изменение интенсивности флуоресценции «Цитохрома-С» при 300нм и 350нм.
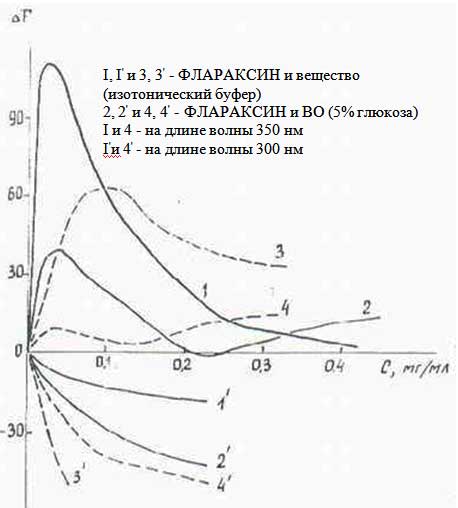 |
Из которого видно, что с возрастанием концентрации ФАВ наблюдается тушение флуоресценции полосы λ=300нм и возгорание при λфл=350нм, что обусловлено, по-видимому, изменением окружения тирозиновых и трипто-фановых остатков с последующим переносом энергии от флуорофора тирозина к триптофану. При этом возгорание триптофановой флуоресценции в присутствии «Флараксина» в ~3 раза эффективнее, чем в присутствии ВО. Насыщение флуоресценции λфл=350нм при введении «Флараксина» достигается при меньших концентрациях (5-7 мг/мл), чем для ВО (12-13 мг/мл). Величины констант тушения Кq, определенные из зависимости F0/ΔF=f(1/c), приведены в Табл.4.2.
| Вещество | Kq, [моль-1•сек-1•л] | |
|---|---|---|
| - | Изотонический буфер | 5% глюкоза |
| Флараксин | ||
| λфл 330 нм | (9,3±0,1)•104 | (1,10±0,05)•105 |
| λфл 350 нм | (1,3±0,1)•104 | (8,0±0,1)•103 |
| λфл 450 нм | (1,0±0,1)•105 | (5,7±0,2)•104 |
| Вещество-основа Флараксина | ||
| λфл 330 нм | (9,4±0,1)•104 | (9,8± 0,10)•105 |
| λфл 350 нм | (1,9±0,1)•103 | (4,4±0,1)•103 |
| λфл 450 нм | - | (2,9±0,2)•104 |
Анализ приведенных в Табл.4.2. констант Кq показывает, что как в изотоническом буфере, так и в растворе 5% глюкозы реакции в области тирозиновых остатков (λ=300 нм) протекает с большей скоростью, чем для триптофановых флуорофоров. Глюкоза вызывает снижение скорости тушения флуоресценции «Цитохрома-С» с «Флараксином», а, следовательно, ингибирование взаимодействия между ними, что обусловлено, по-видимому, ее влиянием на скорость протонного обмена в присутствии «Флараксина» (9).
Спектрофотометрия
Проведено спектрофотометрическое исследование взаимодействия «Циохрома-С» с «Флараксином», «Циклофосфаном», «Проспидином». На Рис.4.3 приведены зависимости оптической плотности Д237 раствора «Циохрома-С» (полосы Соре) от концентрации добавленных ФАВ («Флараксин», «Проспидин», «Циклофосфан») в изотоническом буфере (рН 6,9), так и в растворе 5% глюкозы (рН 6,1). Как видно из рисунка, «Циклофосфан» и «Проспидин» в изотоническом буфере незначительно понижают оптическую плотность γ - формы «Цитохрома-С», а, следовательно, смещают равновесие в сторону образования окисленной формы фермента, в то время как «Флараксин» при малых концентрациях (Сфл <2•10-4 моль/л) незначительно повышает Д237, а при большей концентрации резко снижает оптическую плотность. В растворе 5% глюкозы введение уже малых добавок «Флараксина» приводит к длинноволновому смещению полосы Соре и снижению ее оптической плотности Д237. То-есть результаты эксперимента показывают, с одной стороны, различный характер воздействия на состояние окисления протогема «Флараксина» по сравнению с «Циклофосфаном» и «Проспидином»; с другой стороны, применение в качестве исходной среды 5% глюкозы убирает концентрационную область действия «Флараксина» как восстановителя (область возрастания Д237 в спектре «Цитохрома-С»), способствует образованию окисленной формы «Цитохрома-С».
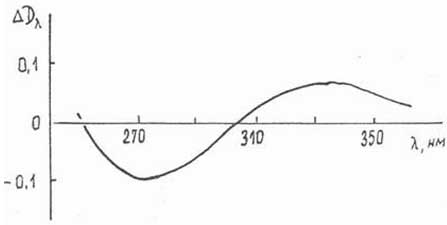
Подтверждением этого может быть проведенное спектрофотометрическое титрование «Флараксина» (раствор в 5% глюкозе) «Цитохромом-С». На Рис.4.4. приведен дифференциальный спектр в координатах ΔDλ - λнм, где ΔDλ = Dλ - D0λ, D0λ и Dλ - оптическая плотность на длине волны λ раствора «Цитохрома-С». И смеси его с «Флараксином» (за вычетом ΔDλ Флараксина). Как можно видеть, отрицательное поглощение (λmax=274нм) и возрастание оптической плотности (λmax=330нм) свидетельствует о том, что окислительно-восстановительная реакция протекает с расходованием компонентов Флараксина, флавоноидов или алкалоидов (12) с образованием комплексов с переносом заряда.
 |
 |
Изучение антирадикальной активности Флараксина и терапевтических препаратов противоопухолевого действия
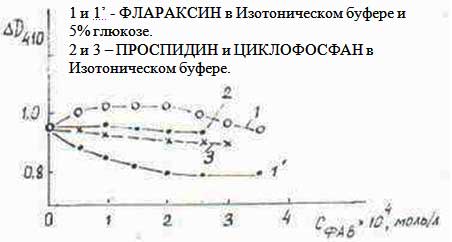
Ранее нами была показана способность Флараксина тормозить перекисное окисление липидов (10). Однако, определение Перекисного Окисления Липидов (ПОЛ) спектрофотометрическим методом по изменению поглощения диеновых конъюгатов не совсем корректно ввиду сложности электронной структуры компонентов Флараксина и изменению спектральных параметров (λmax, Dλ) при взаимодействии. В настоящем исследовании показана способность Флараксина, вещества-основы (ВО), а также «Циклофосфана», «Проспидина» служить ловушкой стабильного радикала Три-Фенил-Вердазина (ТФВ). Исследование проводили в спиртовом растворе ТФВ (концентрация С=10-4 моль/л) в области полос поглощения λmax=402нм и 740нм не перекрывающейся со спектрами ФАВ. Долю нейтрализованного свободного радикала при добавлении в раствор ФАВ определяли как отношение ΔD/D0, где ΔD - изменение оптической плотности D402 или D740 за время τ (час), D0 - оптическая плотность исходного раствора ТФВ. На Рис.4.5(а) приведены зависимости концентрации нейтрализованного ТФВ (α, %) от количества добавленного Флараксина (1) или ВО (2) за время инкубации 10 мин, из которого видно, что Флараксин с большей эффективностью связывает свободный радикал ТФВ, особенно при малых (<3 мг/мл) концентрациях. Нами была изучена кинетика взаимодействия ТФВ с ФАВ. На Рис.4.5(б) приведены величины связываемого радикала (СФАВ=5 мг/мл). во времени при смешивании его с Флараксином (1), ВО (2), а также известными антиоксидантами - Сальвином (3 и13) и Аскорбиновой кислотой. Как можно видеть, аскорбиновая кислота в течение 2-х часов (а также через 48 часов) нейтрализует практически полностью (95%) ТФВ, а затем идет обратный процесс регенерации радикала на 80%. Циклофосфан и Проспидин снижают содержание ТФВ на 1-2% (на рисунке не приведены). Сальвин снижает содержание ТФВ на 5% в течение 4-х часов; ВО наиболее активен в первые 2-4 часа, в дальнейшем содержание ТФВ даже несколько возрастает, в то время как для Флараксина антирадикальная активность постепенно увеличивается. Такие данные согласуются с результатами изучения кинетики ПОЛ, за исключением того, что перекисное окисление лецитина незначительно возрастало в первые часы (~ 3 часа) после смешения.
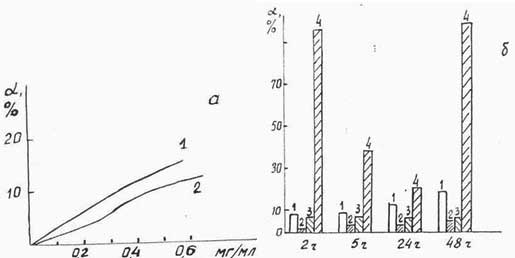 |
Влияние Флараксина и Проспидина на микровязкость общих липидов эритроцитов
Влияние Флараксина на структурно-динамические характеристики мембран-липосом из общих липидов эритроцитов исследовали с помощью флуоресцентного зондирования, применяя в качестве зонда несимметричный полиметиновый краситель 4501у, методика применения которого описана в (6). Для этого краситель инкубировали в среде липосом (20 моль tris НСl буфер, 140 ммоль NаСl, рН 7,4) в отсутствие ФАВ и с их добавкой в различных концентрациях. Изменение вязкости раствора под воздействием ФАВ приводило к изменению интенсивности флуоресценции зонда. На Рис.4.6 приведены зависимости спектрального параметра β (величина, обратнопропорциональная логарифму вязкости).
 |
Как следует из полученных данных, Проспидин при малых дозах незначительно снижает вязкость липосом (β возрастает) и затем не изменяет ее во всем интервале исследуемых концентраций, в то время как Флараксин в дозах менее 0,1 мг/мл повышает вязкость раствора, но дальнейшее возрастание концентрации приводит к уменьшению вязкости (величина β возрастает).
Таким образом, полученные результаты свидетельствуют о различном характере действия Флараксина и Проспидина на структурно-динамическое состояние липосом из общих липидов эритроцитов, индифферентность Проспидина и концентрационно-зависимый характер действия Флараксина, повышающих микровязкость в малых дозах, но снижающих ее с возрастанием концентрации.
Анализируя результаты исследования физико-химических свойств Флараксина, термодинамические характеристики, указывающие на способность его к взаимодействию с био-мембранами и их компонентами, а также сопоставляя такие данные с результатами настоящей работы, можно сделать вывод о широких аспектах действия данного препарата на биологические системы.
Свойство Флараксина, в отличие от других противоопухолевых препаратов, активно взаимодействовать с протогемом «Цитохрома-С», образуя комплекс с переносом заряда, изменять состояние его окисления, должно приводить к перестройке в структуре ближайшего окружения иона железа, что в свою очередь, сказывается на свойствах белкового окружения. Об этом свидетельствуют изменения в флуоресцентных свойствах «Цитохрома-С» под влиянием Флараксина. В отличие от Проспидина и Циклофосфана, не оказывающих действия, Флараксин воздействует на «Цитохром-С» с большей (в ~3 раза) эффективностью, чем ВО, при значительно меньшей концентрации. Надо полагать, что данное свойство Флараксина может иметь значение при терапии опухолевых заболеваний.
Определяющим фактором является также кинетика реакции Флараксина с ферментом, которая, как показано в работе, зависит от условий среды: влияние 5% глюкозы в значительной степени более выражено при взаимодействии ЧСА или «Цитохрома-С» с Флараксином, чем с ВО.
Преимуществом Флараксина по сравнению с Проспидином, Циклофосфаном является также его эффективное, пролонгированное антирадикальное действие, способность влиять на структурно-динамические характеристики мембран из общих липидов эритроцитов, снижать микровязкость. Поэтому представляет интерес оценка подобных изменений на мембранах эритроцитов крови человека в норме и при опухолевых заболеваниях с целью проведения контроля и коррекции лечения Флараксином.
b. Кумулятивные свойства Флараксина и острая токсичность ВО
ВО – вещество-основа Флараксина.
Известно, что накопление в организме активного вещества, т.е. материальная кумуляция, зависит от различных факторов, прежде всего от режима введения вещества. Повторные введения высоких доз вещества, даже быстро выводящих, могут привести к явлениям кумуляции (14).
Выявление эффекта кумуляции проводили по методу, предложенному С.Д.Заугольниковым и соавторами (15).
Флараксин вводили внутримышечно в течение 10 дней в дозе ½ ЛД50 с последующей оценкой весовых коэффициентов внутренних органов (печени, селезенки).
Токсичность Флараксина для белых мышей при внутримышечном введении определяли по методу Прозоровского (16). Изучаемое вещество вводили внутримышечно в 0,5% растворе глюкозы. ЛД50 составила 224 мг/кг.
Для проведения эксперимента было отобрано 3 группы мышей. 1 группа (n=5) – контроль (интактные мыши). 2 группа (n=5) – мыши, получавшие плацебо и содержавшиеся в виварии на обычном рационе в течение 10 дней. 3 группа (n=5) – мыши, которым ежедневно в течение 10 дней вводили Флараксин в дозе ½ ЛД50 (112 мг/кг). Через 1 день после последнего введения Флараксина их взвешивали, забивали декапитацией, извлекали внутренние органы и определяли весовые коэффициенты. Представленные в Табл.4.3. данные свидетельствуют о том, что Флараксин не изменяет массы тела, печени и селезенки, а также весовые коэффициенты изучаемых органов. Следовательно, Флараксин относится к разряду малокумулирующих веществ.
| Группы мышей | Масса тела, г | Масса печени, г | Масса селезенки, г | Весовые коэффициенты | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Исходная | Через 10 сут | Исходная | Через 10 сут | Исходная | Через 10 сут | Печень | Селезенка | |||
| Исходная | Через 10 сут | Исходная | Через 10 сут | |||||||
| 1 группа | 20,8±1,75 | - | 1,144±0,21 | - | 0,201±0,036 | - | 0,05±0,085 | - | 0,01±0,001 | - |
| 2 группа | 20,75±1,75 | 21,8±1,23 | - | 1,19±0,12 | - | 0,216±0,011 | - | 0,054±0,06 | - | 0,01±0,01 |
| 3 группа | 20,6±1,21 | 21,2±1,17 | - | 1,28±0,16 | - | 0,192±0,15 | - | 0,056±0,055 | - | 0,01±0,001 |
Определение острой токсичности вещество основы (ВО) проведено на белых крысах массой 220-300 г.
Все крысы были разбиты на серии, по 2 животных в каждой. Соответствующие навески ВО ex tempore растворяли в 3 мл физиологического раствора и вводили в хвостовую вену крысы по 0,3 мл раствора на 100г массы в течение 2-х минут. После однократного введения препарата учитывали количество выживших и погибших животных (сроки наблюдения 3 сут.), а затем проводили расчет средней смертельной дозы (ЛД50) и ее доверительных границ по методу В. Б. Прозоровского и соавт. (16). Изучены следующие дозы ВО (мг/кг) : 631; 398; 250; 158; 100; 79,4; 63,1 и 50,1 (1 – 8 серий). Животные первых 5 серий погибли в течении 1-2 мин. После введения ВО. В последующих сериях (6-я - 8-я) из двух опытных крыс погибала одна. Это позволило сделать заключение, что ЛД50 ВО составляет 59,0 (41-85) мг/кг.
Учитывая результаты проведенных ранее исследований по определению токсичности Флараксина (ЛД50 для крыс самок и самцов соответственно 241 и 307 мг/кг), можно считать ВО более токсичным препаратом.
c. Изучение влияния Флараксина на иммунологическую реактивность.
Цель работы – изучить влияние Флараксина на гуморальный иммунный ответ по отношению к эритроцитарному и бактериальному антигенам, оценка клеточного иммунитета по реакции гиперчувствительности замедленного типа, а также функциональную активность нейтрофилов.
Гуморальный иммунный ответ на Эритроциты Барана (ЭБ) изучен на белых мышах массой 24 – 28 г. Оценку проводили по титрам циркулирующих антител (гемолизины и гемагглютинины) после внутрибрюшинной иммунизации ЭБ, 108 (оптимальная доза) клеток в объеме 0,2 мл. Антитела учитывали на 7-е сутки после иммунизации на микропанелях способом серийных разведений по методике (17). Наряду с вышесказанным, у мышей регистрировали массу тела, селезенки, тимуса, вычисляли соответственно селезеночный и тимический индексы. Весь цифровой материал подвергали статической обработки (18).
Флараксин вводили в виде 0,1% раствора на 5% глюкозе.
Все животные были распределены на 6 групп: 1 гр. – контроль (интактные, иммунизированные); 2 гр. – опытные мыши, получавшие флараксин однократно внутривенно в дозе 10мг/кг непосредственно после антигенного раздражения; 3 гр.и 4 гр. – животные, которым флараксин вводили внутримышечно 1 раз в сутки в дозе 10мг/кг, соответственно, в течение 6 и 15 дней до иммунизации; 5 гр.– мыши, которым ЭБ вводили в середине 6-ти дневного курса применения флараксина. И наконец, 6-я группу составили животные, которым Флараксин вводили по указанной выше 6-дневной схеме, начиная с момента иммунизации. В каждой серии опытов было 10 животных.
Полученные данные представлены в табл. 4.4, из которой следует, что однократное внутривенное введение Флараксина, а также 6-ти дневное курсовое использование препарата внутримышечно до иммунизации сопровождается достоверным повышением уровня гемолизинов без существенных изменений других изученных показателей. Более длительное (15 суток) введение Флараксина до иммунизации, а также антигенное раздражение в середине 6-ти дневного курсового введения Флараксина не влияют на гуморальный иммунный ответ. В то же время применение Флараксина после иммунизации приводит к достоверному снижению уровня гемагглютининов, но не влияет на титры гемолизинов.
| № серии | Характер опыта | Стат. показат. | Масса тела, г | Масса селезенки, мг | Селезеночный индекс | Масса тимуса, мг | Тимический индекс | Титры антител, lg2 | |
|---|---|---|---|---|---|---|---|---|---|
| Гемма-глютин | Гемо-лизины | ||||||||
| 1. | Контрольная группа(интактные, иммунизированные) | M±m | 29±1,4 | 215,9±9,3 | 0,757±0,065 | 33,1±4,75 | 0,118±0,022 | 8,6±0,4 | 10,4±0,25 |
| 2. | Мыши, получавшие Флараксин однократно внутривенно после антигена | M±m | 27,9±1,9 | 253,9±48,4 | 0,956±0,233 | 42±6,3 | 0,154±0,026 | 8,7±0,55 | 11,8X±0,33 |
| 3. | Мыши, получавшие Флараксин внутримышечно 1 раз в сутки в течение 6 дней до иммунизации | M±m | 27,9±0,7 | 201,3±15,7 | 0,726±0,058 | 33,1±3,3 | 0,119±0,012 | 8,3±0,11 | 11,6X±0,2 |
| 4. | Мыши, получавшие Флараксин внутримышечно 1 раз в сутки в течение 15 дней до иммунизации | M±m | 27,4±0,6 | 231,4±23,2 | 0,842±0,08 | 45,3±5,0 | 0,166±0,02 | 8,3±0,2 | 10,7±0,3 |
| 5. | Мыши, иммунизированные в середине 6-дневного курсового введения флараксина | M±m | 26,8±0,8 | 213,5±11/td> | 0,810±0,064 | 40,9±5,7 | 0,155±0,02 | 8,4±0,22 | 11,3±0,33 |
| 6. | Мыши, получавшие Флараксин внутримышечно 1 раз в сутки в течение 6 дней после иммунизации | M±m | 26,0±0,9 | 267,7±38,3 | 1,055±0,169 | 38,4±2,5 | 0,147±0,023 | 6,8X±0,37 | 11,1±0,25 |
Примечание: X –достоверность по отношению к контролю.
Таким образом, проведенные исследования показали, что применение Флараксина до иммунизации или одновременно с ней не оказывают отрицательного влияния на выработку антител к эритроцитарному антигену.
В опытах на белых крысах линии Вистар исследовали гуморальный иммунный ответ на бактериальный антиген. В качестве последнего использовалась гретая брюшнотифозная вакцина Уфимского Института Вакцин и Сывороток им. Мечникова. Иммунизацию проводили однократным подкожным введением вакцины в дозе 0,1 мл/100г массы тела. На 7-е сутки определяли титры О-агглютинов методом линейного титрования сыворотки крови. Опытные серии (по 10 животных в группе) были идентичны по дозам и схемам применения, предыдущим экспериментам на белых мышах.
Полученные результаты представлены в Табл.4.5., из которой видно, что Флараксин в разовой дозе 10мг/кг при различных схемах его использования не изменяет процесса антителообразования.
С целью изучения влияния Флараксина на клеточное звено иммунного ответа, в частности на функциональную активность лимфоцитов Т-ряда, нами была выбрана реакция гиперчувствительности замедленного типа (ГЗТ). Индукцию реакции ГЗТ осуществляли методом (17). Опыты проведены на 80 белых мышах массой 20-22 г. Животных сенсибилизировали внутрибрюшинным введением Эритроцитов Барана (ЭБ) в дозе 1∙107 на 20 г массы тела. На 5-е сутки после иммунизации в подушечку задней лапы инъецировали разрешающую дозу антигена (108 клеток в объеме 20мкл).
| № серии | Характер опыта | Стат. показат. | Масса тела, г | Масса селезенки, мг | Селезеночный индекс | Масса тимуса, мг | Тимический индекс | Титры О-агглюти-нинов, lg2 |
|---|---|---|---|---|---|---|---|---|
| 1. | Контрольная группа (интактные, иммунизированные) | M±m | 195±20,1 | 702,1±71,6 | 0,374±0,039 | 504,9±61 | 0,252±0,022 | 5,1±0,35 |
| 2. | Введение Флараксина однократно внутривенно после иммунизации | M±m | 194,4±10,6 | 911±97,9 | 0,463±0,041 | 542±54,7 | 0,282±0,027 | 6.8±0,71 |
| 3. | Введение Флараксина внутри-мышечно в течение 6 дней до иммунизации | M±m | 195,8±8,8 | 791,8±8,3 | 0,41±0,046 | 492.3±72 | 0,25±0,028 | 4,8±0,08 |
| 4. | Введение Флараксина внутри-мышечно в течение 15 дней до иммунизации | M±m | 204,7±13,1 | 887,6±65,1 | 0,435±0,025 | 532,6±65,6 | 0,265±0,036 | 5,1±0,29 |
| 5. | Мыши, иммунизированные в середине 6-дневного курсового введения флараксина | M±m | 199,4±11,7 | 921±86,7 | 0,461±0,033 | 462±55,9 | 0,238±0,034 | 6,4±0,35 |
| 6. | Мыши, получавшие Флараксин внутримышечно 1 раз в сутки в течение 6 дней после иммунизации | M±m | 179,6±4,91 | 886,9±80,6 | 0,5±0,061 | 456,6±33,3 | 0,255±0,022 | 6,1±0,14 |
В контрольную лапу вводили стерильный физиологический раствор в том же объеме. Реакцию оценивали спустя 24 часа по разнице в массе регионарных подколенных лимфоузлов опытной и контрольной конечностей (19) и высчитывали индекс реакции ГЗТ.
Контрольные серии составили животные, не получавшие Флараксин, а опытные серии (по схемам применения Флараксина) были идентичны вышеописанным. Полученные результаты представлены в Табл.4.6.
| № серии | Характер опыта | Стат. показат. | Масса тела, г | Масса селезенки | Масса тимуса | Масса лимфоузла, мг | Индекс ГЗТ | |||
|---|---|---|---|---|---|---|---|---|---|---|
| мг | % | мг | % | Опытн. | Контр. | |||||
| 1. | Контр. группа - 1 (интактные животные) |
M±m | 21,3±0,43 | 148,1±13 | 0,694±0,054 | 67,1±8,7 | 0,316±0,041 | 3,16±0,3 | 2,76±0,36 | 1,19±0,12 |
| 2. | Контр. группа - 2 (не иммунизированные, но получившие разрешающую дозу антигена) |
M±m | 22,4±0,7 | 160,6±12,9 | 0,711±0,044 | 48,4±3,3 | 0,217±0,015 | 3,34±0,37 | 2,97±0,26 | 1,13±0,11 |
| 3. | Контр. группа - 3 (реакция ГЗТ у животных, не получавших Флараксин) |
M±m | 19,8±0,6 | 147,1±12,5 | 0,741±0,045 | 57,2±3,4 | 0,289±0,016 | 3,68±0,28 | 2,76±0,19 | 1,43±0,08 |
| 4. | Мыши, получавшие Флараксин однократно внутривенно после сенсибилизации ЭБ | M±m | 20,1±0,5 | 174,5±12,2 | 0,863±0,041 | 49,5±4,5 | 0,247±0,022 | 3,53±0,21 | 2,57±0,23 | 1,48±0,1 |
| 5. | Мыши, получавшие Флараксин внутримышечно 1 раз в день в течение 6 сут до сенсибилизации | M±m | 20,5±0,5 | 190±16,5 | 0,931±0,079 | 72,6±4,4 | 0,354±0,02 | 4,66±0,28 | 3,15±0,31 | 1,6±0,12 |
| 6. | Мыши, получавшие Флараксин внутримышечно 1 раз в день в течение 15 сут до сенсибилизации | M±m | 21,1±0,5 | 168,8±8,3 | 0,798±0,041 | 59,1±3,7 | 0,279±0,014 | 4,17±0,36 | 2,5±0,2 | 1,67±0,09 |
| 7. | Мыши, сенсибилизированные ЭБ в середине 6-дневного курсового введения Флараксина | M±m | 20,2±0,4 | 159,9±6,4 | 0,852±0,029 | 57,9±5,3 | 0,287±0,0281 | 4,76±0,26 | 2,92±0,32 | 1,63±0,1 |
| 8. | Мыши, получавшие Флараксин внутримышечно 1 раз в день в течение 6 дней после сенсибилизации | M±m | 21,3±1,1 | 157,8±9,7 | 0,739±0,024 | 56,3±5,2 | 0,262±0,019 | 3,86±0,25 | 2,28±0,18 | 1,55±0,16 |
Как видно из данных Табл.4.6., Флараксин при различных вариантах применения в разовой дозе 10мг/кг не влияет на развитие клеточной иммунной реакции.
В качестве одного из показателей неспецифической резистентности организма, отражающего функциональное состояние клеточных факторов защиты, нами была изучена активность нейтрофилов. При этом учитывались: КП – коэффициент поглощения микробов (активность фагоцитоза); ФИ – фагоцитарный индекс (% активных фагоцитов) и КЗ – коэффициент завершенности фагоцитоза (степень переваривания поглощенных микробов). В качестве тест-микроба использовалась суточная культура S.Thyphimurium. Исследования проведены в динамике у белых мышей, получавших Флараксин по наиболее напряженной схеме – 15 суток по 10 мг/кг ежедневно. Данные экспериментов представлены в Табл.
Приведенные в Табл.4.7. данные показывают, что курсовое введение Флараксина в течение 15 дней существенно не изменяет ни числа фагоцитирующих клеток, ни активность поглощения микробов, ни их переваривающую способность.
Таким образом, проведенные эксперименты свидетельствуют, что в изученной дозе (10 мг/кг) и в избранных схемах применения Флараксин не оказывает отрицательного влияния на некоторые показатели гуморального и клеточного звеньев иммунологической реактивности организма в норме.
| Изучаемые показатели | Стат. показат. | Контроль (интактные животные) | Сроки наблюдения (сут) в процессе введения флараксина | Через 7 сут после окончания введения препарата | ||
|---|---|---|---|---|---|---|
| 1 | 7 | 15 | ||||
| Коэффициент поглощения микробов | M±m | 4,54±0,35 | 3,84±0,33 | 3,74±0,24 | 3,37±0,25 | 3,62±0,36 |
| Фагоцитарный индекс |
M±m | 0,372±0,016 | 0,38±0,02 | 0,38±0,028 | 0,37±0,015 | 0,38±0,013 |
| Коэффициент завершенности фагоцитоза | M±m | 0,44±0,12 | 0,364±0,034 | 0,294±0,054 | 0,39±0,05 | 0,38±0,03 |
Вместе с тем, имеются предпосылки (усиление выработки гемолизинов) считать, что этот препарат может стимулировать функциональную активность системы иммунной защиты. Такие свойства Флараксина могли бы иметь определенное значение в условиях его применения в онкологических клиниках.
В то же время отдельные данные (снижение выработки гемагглютининов после применения препарата) свидетельствуют об обратном воздействии Флараксина на иммуногенез. Для ответа на эти вопросы необходимо проведение специальных экспериментов, предполагающих выявление дозозависимых эффектов у Флараксина. Необходимо отметить, что в клинике этот препарат рекомендуют использовать в суточной дозе до 2 мг/кг. Поэтому в эксперименте, очевидно, следует изучить иммунные свойства препарата при дозах, меньших 10 мг/кг, в частности 1, 3, 5 мг/кг, чему и будут посвящены наши последующие опыты.
d. Исследование антиоксидантных свойств Флараксина и активности аминотрансфераз в крови больных, пролеченных флараксином.
Определение активности аминотрансфераз в сыворотке крови больных онкопатологией и при лечении флараксином показало (табл.4.8), что при онкопатологии возрастает активность как аспартат-, так и аланин- аминотрансферазы по сравнению со здоровыми донорами (табл.4.9 ).
| № ПП | Ф.И.О. | До лечения | После лечения | ||
|---|---|---|---|---|---|
| Аст | Алт | Аст | Алт | ||
| 1 | Панченко А.Г. | 1,96 | 1,96 | 2,62 | 3,72 |
| 2 | Коваленко | 1,30 | 2,40 | 3,06 | 4,83 |
| 3 | Савичева | 0,86 | 0,64 | 3,50 | 2,62 |
| 4 | Хатункина | 0,64 | 2,21 | 3,50 | 3,06 |
| 5 | Джунковский | 1,06 | 2,40 | 2,84 | 3,72 |
| 6 | Кмитинский | 0,20 | 0,75 | 1,96 | 4,82 |
| 7 | Коваленко | - | - | 3,06 | 4,83 |
| 8 | Гурьянов | - | - | 1,52 | 2,28 |
| 9 | Кулик | - | - | 2,67 | 5,26 |
| 10 | Ирабилина | 1,52 | 0,64 | - | - |
| 11 | Ленк | 2,20 | 0,86 | - | - |
| 12 | Хоменко | - | - | 1,51 | 3,3 |
| 13 | Зозуля | 2,18 | 0,42 | - | - |
| 14 | Горобец | - | - | 2,84 | 1,08 |
| Среднее | 1,33 | 1,36 | 2,64** | 3,59** | |
Примечание: ** - p < 0,01 (по сравнению с больными).
| Аспартат-аминотрансфераза | 0,49 |
| Аланин-аминотрансфераза | 0,80 |
Примечание: Активность ферментов определяли с помощью стандартных наборов фирмы "Хемапол" (ЧССР).
Это может быть обусловлено нарушением целостности биомембран (прежде всего, клеток печени) у онкологических больных.
Лечение Флараксином приводит к еще большему росту ферментативной активности в сыворотке (табл. 4.8.). Это можно объяснить либо еще большим повреждением биомембран, либо стимуляцией ферментов непосредственно ФЛАРАКСИНОМ, находящимся в сыворотке. Для проверки второго предположения были проведены опыты по определению возможного влияния ФЛАРАКСИНА на активность аспартат-и аланин-аминотрансфераз в сыворотке крови здоровых людей в условиях in vitro (табл. 4.10.).
| Фермент | Контроль | Флараксина | Контроль | Флараксинб |
|---|---|---|---|---|
| Аст | 0.53 | 0.86* | 0,31 | 1.41** |
| Алт | 0,64 | 2,57** | 1,08 | 1,19 |
Примечания: * - p<0,05; ** - p<0,01 (по сравнению с контролем);
а - 2мг Флараксина + 0,05мл сыворотки;
б - 0,01мг Флараксина + 0,05мл сыворотки.
Приведенные данные свидетельствуют о том, что находящийся в крови леченых больных Флараксин может вызывать неспецифическое повышение ферментативной активности. Возможно, это обусловлено взаимодействием Флараксина с молекулами ферментов, приводящим к раскрытию дополнительных активных центров, что ведет к повышению их активности.
Активность аминотрансфераз отражает функциональное состояние клеток печени/(20). В качестве критерия, определяющего целостность субклеточных структур гепатоцитов, определяли интенсивность процессов Перекисного Окисления Липидов (ПОЛ).
Требовалось также выяснить, связан ли лечебный эффект Флараксина с его возможными антиоксидантными свойствами.
Учитывая вышеизложенное, в опытах на животных было изучено влияние Флараксина на интенсивность процессов ПОЛ в гомогенатах печени.
В работе использовали крыс линии «Вистар» весом 150-200г (3 мес.). Флараксин вводили в физиологическом растворе внутривенно в дозе 4 (терапевтическая доза) и 40 мг/кг массы тела. Через 2 часа животных декапитировали и 1г печени гомогенизировали в 5мл раствора 0,25 М сахароза, 3мМ ЭДТА. В гомогенатах определяли содержание белка по методу Лоури и соавт. (21) и скорость накопления Малонового Диальдегида (МДА) (22). Определяли интенсивность НАДФН- и аскорбат-зависимого переокисления (НЗП и АЗП, соответственно), ферментативную составляющую НЗП (НЗП, Δ), а также неинициированного ПОЛ. Результаты выражали в нмоль МДА/мг белка гомогената. Результаты исследования представлены в таблице 4.11.
| Показатели ПОЛ | Контроль | Флараксин | |
|---|---|---|---|
| 4 мг/кг | 40 мг/кг | ||
| НЗП | 12419,9 | 8049,3* | 13535,1 |
| НЗП, Δ | 6819,6 | 5226,0 | 9520,0* |
| АЗП | 6335,3 | 5429,5 | 4277,3 |
| Неинициир.контроль | 0 | 0 | 195,9* |
Примечание: В качестве контроля использовали интактных животных; * - р < 0,05 (по сравнению с контролем).
Установлено, что Флараксин в терапевтической дозе обладает антиоксидантным действием, вызывая снижение инициированного ПОЛ, особенно выраженное в случае НАДФН-зависимого липопереокисления.
Более высокая доза Флараксина, наоборот, вызывает стимуляцию ПОЛ (в особенности НЗП, Δ и неинициированное ПОЛ), связанную, возможно, с повреждением субклеточных структур гепатоцитов данным препаратом.
Осталось невыясненным, связано ли подобное антиоксидантное действие Флараксина с его непосредственным влиянием на процессы ПОЛ в клетках печени, либо оно опосредуется влиянием других метаболических систем организма.
В связи с этим, нами было изучено влияние Флараксина на процессы ПОЛ в гомогенатах печени в условиях in vitro (то есть, при отсутствии влияния регуляторных систем организма.)
Результаты определения влияния Флараксина на процессы ПОЛ в гомогенатах печени интактных крыс в условиях in vitro приведена в Таблице 4.12.
| Показатели ПОЛ | Контроль | Флараксин | |
|---|---|---|---|
| 0,25 мг/мл | 7,5 мг/мл | ||
| НЗП | 6689,4 | 2614,3* | 2800,0* |
| НЗП, Δ | 4628,7 | 132,2* | 716,7* |
| АЗП | 5808,6 | 181,1* | 96,0* |
| Неинициир.контроль | 623,5 | 397,4* | 804,9 |
Примечание: НЗП-НАДФН-зависимое ПОЛ (перекисное окисление липидов);
НЗП, Δ - зависимая от нагревания составляющая этого процесса;
АЗП-аскорбат-зависимое ПОЛ;
* - р < 0,05 (по сравнению с контролем).
Как видно, Флараксин, добавленный к гомогенатам печени, вызывает резкое подавление процессов индуцированного НАДФН и аскорбатом ПОЛ. Что касается неинициированного ПОЛ, то в этом случае антиоксидантное действие этого вещества обнаружено только при меньшей концентрации препарата (0,2 мг/мл).
Приведенные результаты показывают, что антиоксидантное действие Флараксина на процессы ПОЛ в печени обусловлено непосредственным влиянием препарата на эти процессы без участия регуляторных систем организма. Сравнивая эти результаты с данными о влиянии Флараксина на процессы ПОЛ в печени в условиях in vivo, можно видеть, что in vitro антиоксидантный эффект проявляется в большей степени. Одной из причин подобного несоответствия может быть возможное разложение препарата в организме, и, как следствие этого, действие на процессы ПОЛ в организме метаболитов Флараксина с менее выраженными антиоксидантными свойствами. В случае правильности подобного предположения можно рекомендовать применение стабилизаторов данного препарата при его использовании в качестве антиоксиданта в условиях целостного организма.
В данной работе изучали действие Флараксина на изменение интенсивности ПОЛ в гомогенатах печени крыс в условиях интоксикации тетрахлорметаном (1 ЛД50). Флараксин вводили одновременно с ядом в терапевтической дозе - 4 мг/кг массы тела. Среди крыс, отравленных тетрахлорметаном, не получавших Флараксин, доля выживших животных составила 40%, а среди получавших Флараксин - 67,7%. Через 2 ч после введения яда в гомогенатах печени растет количество продуктов ПОЛ - диеновых конъюгатов в гептановом слое липидного экстракта (табл.4.13).
| Гептановый слой | Изопропанольный слой | ||||
|---|---|---|---|---|---|
| Контроль | Тетрахлорметан | Тетрахлорметан + Флараксин | Контроль | Тетрахлорметан | Тетрахлорметан + Флараксин |
| 55,9 | 122,7* | 113,4* | 833,0 | 794,3 | 561,8 |
Примечание: * - p < 0,05 (по сравнению с контролем); результаты обрабатывали методами непараметрической статистики, не требующими вычисления m.
Введение Флараксина несколько снижает количество продуктов ПОЛ (на 7,7%), однако их количество остается повышенным по сравнению с контролем. В изопропанольном слое липидного экстракта антиоксидантный эффект Флараксина проявляется в снижении на 32,6% количества диеновых конъюгатов по сравнению с контролем.
Таким образом, установлено гепатопротекторное действие Флараксина при отравлении животных тетрахлорметаном. Это действие связано с антиоксидантным эффектом Флараксина.
Итак, результаты проведенных исследований свидетельствуют о наличии у Флараксина значительной антиоксидантной активности, в особенности в условиях in vitro, превосходящей активность классических антиоксидантов, в частности, α-токоферола. Активность препарата в условиях in vitro выражена в гораздо меньшей степени. Антиоксидантные свойства Флараксина обусловливают его гепатопротекторный эффект в условиях интоксикации тетрахлорметаном.
e. Поиск средств лечения отравлений, вызванных передозировкой Флараксина.
Опыты осуществлены на 12-ти ненаркотизированных собаках, которым внутривенно медленно вводили Флараксин в различных дозах в виде 0,75% раствора на 5 % растворе глюкозы.
В предварительных экспериментах на 3 животных установлено, что Флараксин в разовых дозах 40, 60 и 80 мг/кг не приводит к каким-либо заметным изменениям поведения собак. И только при введении Флараксина в количестве, превышающем в 50 раз рекомендованную (суточную) для клиники (2мг/кг) дозу, проявлялись определенные симптомы отравления. Из 4 контрольных собак погибли 2 – на 1 и 2-е сутки. Обследование животных проводили два-три раза до опыта, а затем через 2 часа, на 1, 3 и 5 сутки после введения Флараксина.
У животных исследовали основные параметры четырех компонентов газового гомеостаза: дыхательного, циркуляторного, гемического и тканевого.
При изучении состояния внешнего дыхания определяли легочную и альвеолярную вентиляцию, спирограмму, потребление О2 и СО2 в легких, дыхательный коэффициент и дыхательный эквивалент, состав альвеолярного воздуха, частоту дыхания и индекс вдох/выдох (23).
О гемодинамике судили на основании изучения минутного объема кровообращения, ударного объема сердца, частоты сокращений сердца, скорости кровотока и индекса вентиляция/кровоток (24).
Показателями состояния дыхательной функции крови служили Р 50 крови, кислородная емкость крови, содержание и парциальное давление О2 и СО2 артериальной и венозной крови, насыщение крови кислородом (25). Определялись также кривые диссоциации оксигемоглобина. По изменениям артерио-венозной разницы по кислороду О2, венозно-артериальной по углекислому газу СО2, коэффициента утилизации кислорода О2 тканями, данным кислотно-основного состояния крови, по содержанию в крови органических кислот судили об уровне потребления кислорода тканями и выделения ими углекислоты (26, 27, 28).
Артериальную кровь для исследований получали путем пункции бедренной артерии, смешанную венозную – пункцией наружной яремной вены с последующим введением катетера в полость правого предсердия.
Цифровой материал обработан статически (29).
Проведенные эксперименты показали, что у контрольных собак после однократного введения Флараксина в дозе 100мг/кг клиническая картина интоксикации характеризовалась быстрым возникновением выраженной гиподинамии, саливации, рвоты, частыми мочеиспусканиями. Животные плохо реагировали на внешние раздражители. В месте внутривенного введения Флараксина длительное время (до 2 часов) отмечалось кровотечение. Через 1 сутки состояние гиподинамии сохранялось.
При исследовании показателей газового гомеостаза наблюдалось быстрое (через 2 часа) понижение Р 50 крови (с 4,09±0,07 до 3,36±0,12 кПа) и на этом уровне удерживалось до 3 суток включительно. При этом кривая диссоциации оксигемоглобина смещалась влево в нижнем отрезке и к низу в области верхней инфлекции.
При увеличении концентрации углекислоты в газовых смесях для определения кривой диссоциации до 8 кПа форма ее и точки построения ее оставались такими же, как при Р СО2 в 5,33 к Па, т.е. «эффект Бора» отсутствовал. Подобные изменения отдачи кислорода кровью наблюдались и на 1 сутки (Рис.4.7). Из других изменений газового гомеостаза следует отметить через 2ч, 1 сут и 3 сут значительное (более чем в 2 раза) снижение артерио-венозной разницы по кислороду, некоторое уменьшение содержания и парциального давления СО2 в артериальной и венозной крови, а также значений дыхательного коэффициента (с 0,762±0,003 до 0,696±0,009 на 1 сут и 0,721±0,006 на 3 сут.).
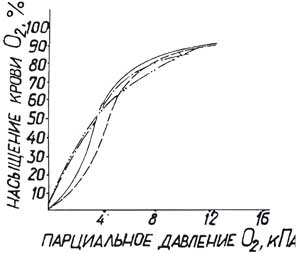 |
Условные обозначения:
Кривая диссоциации оксигемоглобина при Р СО2 5,33 кПа ( ______ до опыта; _._._._ через 1 сут)
Кривая диссоциации оксигемоглобина при Р СО2 8 кПа ( - - - - - до опыта; _.._.._.. через 1 сут)
В эти же сроки у животных отмечены явления субкомпенсированного метаболического ацидоза (РН артериальной крови падала с 7,376±0,007 до 7,312±0,008 и 7,318±0,009 и 7,322±0,009 соответственно срокам, а дефицит увеличивался с -2,3 до -4,5 м∙моль/л).
На 6 сут после введения Флараксина большинство параметров кислородного режима организма и транспорта углекислоты были в пределах исходных значений.
Таким образом, у собак после внутривенного введения Флараксина в дозе 100мг/кг быстро развивается тканевая кислородная недостаточность, свидетельствами которой являются снижение потребления кислорода тканями, а также артериальная и венозная гипокапния. Учитывая наличие высокого сродства гемоглобина к кислороду, можно думать, что такая гипоксия является вторичной, т.е. возникает в результате ухудшения отдачи кислорода кровью. Кроме того, «стабилизирующее» действие Флараксина на способность гемоглобина связывать кислород может привести к возникновению нарушений функций отдельных органов. Особое значение при этом может иметь смещение верхнего отрезка диссоционной кривой книзу. В таких условиях высокодифференцированные ткани (нервная ткань и мышцы сердца) получают ограниченное количество кислорода.
Для выявления возможного кардиотоксического действия осуществляли мониторинг состояния сердечно-сосудистой системы путем регистрации поликардиограммы (ЭКГ, ФКГ и реограммы тела) в следующие сроки: исходные данные, 15, 30, 60 мин, 1, 3 и 6 сут после введения Флараксина. При этом регистрировали массу тела, общее сопротивление тела, частоту сердечных сокращений (ЧСС), высоту калибровочного импульса, величину реокардиографической волны, расчетным путем определяли площадь тела животного, ударный и минутный объемы крови (УОК и МОК), ударный и сердечный индекса (УИ и СИ) кровообращения.
Реакция сердечно-сосудистой системы в ответ на введение изучаемого препарата проявилась в снижении частоты сердечных сокращений на 15-й мин у 6 животных из семи, на 30-й мин – у 5 из 7 животных и на 60-й мин – у 5 из 7 животных соответственно.
Через 1 сут у большинства животных частота сердечных сокращений превышала исходный уровень.
Основные гемодинамические показатели (УОК, МОК, УИ и СИ) в указанные сроки наблюдения не изменялись (см. табл.4.14).
| Сроки наблюдения | Стат. Показ. | ЧСС, уд/мин | Ударный объем кровообращения, мл/мин | Минутный объем кровообращения, мл/мин | Ударный индекс, мл/мин | Ердечный индекс, мл/мин |
|---|---|---|---|---|---|---|
| Исходные | M±m | 136,7±10,3 | 6,2±1,0 | 868,7±161,4 | 13,5±1,9 | 1875,9±295,8 |
| 15 мин | M±m | 108,8±8,6 | 6,4±0,8 | 723,4±141,5 | 14,1±1,4 | 1546,6±220,3 |
| 30 мин | M±m | 122,2±10,3 | 6,1±0,6 | 467,1±123,5 | 13,6±1,2 | 1661,7±195,8 |
| 60 мин | M±m | 119,4±12,0 | 7,1±0,8 | 893,5±191,6 | 15,5±1,3 | 1887,0±261,9 |
| 1 сут | M±m | 147,4±24,8 | 5,5±0,6 | 930,9±147,3 | 12,2±1,2 | 2017,9±239,4 |
| 3 сут | M±m | 132,5±11,0 | 6,8±1,2 | 867,3±94,2 | 14,3±2,8 | 1813,7±164,5 |
| 6 сут | M±m | 143,0±3,0 | 6,7±1,1 | 965,9±165,3 | 14,3±2,5 | 2060,7±378,4 |
Полученные данные дают основание утверждать, что препарат Флараксин при однократном внутривенном введении больших доз (100мг/кг) не оказывает выраженного кардиотоксического эффекта.
Учитывая, что у некоторых собак имела место кровоточивость из мест прокола вены иглой, мы у 3 животных изучили некоторые показатели гемокоагуляции (Табл.4.15).
| Показатели | Исходные данные | Время после введения препарата, сут | ||||
|---|---|---|---|---|---|---|
| 5 мин | 1 час | 1 сут | 3 сут | 6 сут | ||
| Собака «Джуся» | ||||||
| Гематокрит | 0,55 | Кровь не свернулась | 0,56 | 0,65 | 0,58 | 0,56 |
| Фибринолиз, % | 36,4 | 35,7 | 53,0 | 75,3 | 41,6 | |
| Фибриноген, г/л | 5,9 | - | 4,2 | 5,9 | 4,8 | |
| R, мин | 4,5 | 6,0 | 16,5 | 8,3 | 4,3 | |
| S15 | 188 | 241 | 84 | 167 | 220 | |
| Собака «Бондя» | ||||||
| Гематокрит | 0,52 | - | 0,63 | 0,60 | 0,59 | 0,46 |
| Фибринолиз, % | 48,1 | - | 76,1 | 72,3 | 22,6 | 29,2 |
| Фибриноген, г/л | 8,9 | 5,6 | 7,8 | 10,0 | 8,9 | 10,5 |
| R, мин | 4,8 | - | 3,5 | 6,8 | 5,3 | 5,9 |
| S15 | 246 | - | 261 | 200 | 189 | 240 |
| Собака «Ника» | ||||||
| Гематокрит | 0,45 | - | - | 0,49 | 0,49 | 0,46 |
| Фибринолиз, % | 18,5 | - | - | 30,6 | 74,8 | 100 |
| Фибриноген, г/л | 9,8 | - | - | 5,04 | 5,04 | 4,8 |
| R, мин | 4,2 | - | - | 5,8 | 9,9 | 1,6 |
| S15 | 282 | - | - | 180 | 199 | 220 |
Фибринолиз исследовали по методу Котовщиковой и Кузник (30), фибриноген цельной крови – суховоздушным методом, на приборе АГКМI-01 записывали тромбоэластограмму (в частности, время свертывания R и площадь записи в течение 15 мин).
Эти эксперименты показали, что большие дозы Флараксина могут приводить к появлению признаков, характерных для тромбогеморрагического синдрома – повышение гематокрита, фибринолитической активности, увеличение времени свертываемости крови (R), некоторое снижение концентрации фиброгена (S15). Изменения такого плана регистрируются до 3 сут включительно.
При разработке терапии отравлений, вызванных воздействием больших доз Флараксина, мы исходили из следующих положений: во-первых, необходимо быстро прервать цепь патологических реакций, ведущих к возникновению вторичной тканевой гипоксии. В этом случае необходимо применение препаратов, как влияющих на процессы связывания кислорода кровью, так и лекарственных средств, улучшающих потребление кислорода тканями. Во-вторых, целесообразно было применение сосудоукрепляющих средств. И, наконец, полагая, что Флараксин в больших дозах оказывает существенное влияние на периферические медиаторные процессы (саливация, рвота и др.) – препараты, предупреждающие это действие.
В качестве таких лекарственных средств были избраны «Никотинамид», «Глюконат-кальция» и «Димедрол». Указанные препараты вводили внутримышечно в следующих дозах: Никотинамид – 2мг/кг в виде 2,5% водного раствора, Димедрол – в виде 1% раствора в дозе 0,5мл и Кальция-глюконат – в виде 10% раствора 5мл на животное. Димедрол и Глюконат-кальция вводили однократно в течение первых 30 мин, а Никотинамид инъекцировали 5 раз: через 30 мин, 2 ч, на 1, 2 и 3 сут после введения Флараксина. При назначении Никотинамида мы исходили из того, что он не только улучшает процессы тканевого дыхания, но и может положительно влиять на отдачу кислорода кровью, смещая кривую диссоциации оксигемоглобина вправо в среднем в ее отрезке (31).
Результаты проведенных на 5-ти собаках экспериментов представлены в Табл.4.16-4.18.
| Сроки наблюдения | Стат. Показ. | Транспорт кислорода 02 кровью | Транспорт СО2 кровью | Показатели гемодинамики | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| КЕК | СО2а | СО2в | Са-в | SО2а | SO2в | R1 | P O2a | P O2в | Р 50 | С СО2в | С СО2а | Св-а | Р СО2в | Р СО2а | Q | R2 | |||
| Исходные данные | M±m | 9,77 0,20 | 9,20 0,20 | 6,81 0,21 | 2,38 0,06 | 94,1 0,28 | 69,7 1,09 | 0,24 0,008 | 12,42 0,11 | 5,69 0,09 | 4,15 0,05 | 18,54 0,12 | 16,11 0,14 | 2,43 0,04 | 6,03 0,06 | 5,23 0,02 | 2,62 0,07 | 0,89 0,03 | |
| 1 сут | M±m | 9,80 0,29 | 9,32 0,30 | 7,74* 0,30 | 1,58* 0,10 | 95,1 0,47 | 79,0* 1,81 | 0,16* 0,01 | 12,48 0,31 | 5,84 0,30 | 3,60* 0,08 | 16,36* 0,39 | 14,83* 0,41 | 1,53* 0,06 | 5,3* 0,11 | 4,69* 0,17 | 3,32* 0,31 | 0,63* 0,06 | |
| 3 сут | M±m | 9,82 0,31 | 9,24 0,28 | 6,24 0,41 | 3,00 0,20 | 94,1 0,41 | 63,5 2,24 | 0,31 0,03 | 12,32 0,13 | 4,64* 0,24 | 3,71* 0,09 | 16,83* 0,48 | 14,17* 0,38 | 2,66 0,16 | 5,67 0,22 | 4,75* 0,17 | 1,75* 0,17 | 1,21* 0,09 | |
| 6 сут | M±m | 9,60 0,25 | 9,33 0,20 | 6,30* 0,27 | 3,03* 0,21 | 93,9 1,15 | 62,3 1,01 | 0,32* 0,14 | 12,45 0,17 | 4,67* 0,16 | 3,84* 0,07 | 16,78* 0,30 | 13,93* 0,29 | 2,85* 0,31 | 6,27 0,17 | 5,12 0,15 | 1,98* 0,13 | 1,14 0,15 | |
Условные обозначения:
СО2а и СО2в – содержание О2 в артериальной (а) и венозной (в) крови, моль/л;
КЕК – кислородная емкость крови; а-в и в-а – артерио-венозная и венозно-артериальная разница;
SО2а и SO2в – насыщение артериальной или венозной крови кислородом, %;
Р 50 и P O2 – при котором кровь насыщена кислородом на 50%;
P O2 и Р СО2 – парциальное давление О2 или СО2 в артериальной (а) или венозной (в) крови, кПа;
С СО2в и С СО2а – содержание углекислоты в венозной (в) или артериальной (а) крови, моль/л;
Q – минутный объем кровообращения, л; R1 – коэффициент утилизации кислорода тканями;
R2 – отношение вентиляция/перфузия.
Примечание к Табл.4.16: n=5; * - P<0,05.
| Сроки исследования | Стат. Показ. | У | E О2 | E СО2 | R3 | f | R4 | УЕ | УА | P O2А | Р СО2А |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходные данные | M±m | 4,65 0,34 | 0,140 0,003 | 0,106 0,002 | 0,755 0,003 | 22,0 0,94 | 1,09 0,11 | 33,1 0,92 | 2,33 0,06 | 13,28 0,04 | 5,21 0,03 |
| 1 сут | M±m | 5,40* 0,34 | 0,117* 0,003 | 0,083* 0,002 | 0,704 0,008 | 24,8 2,61 | 1,05 0,08 | 46,2* 2,24 | 2,12* 0,05 | 13,48 0,22 | 4,48* 0,20 |
| 3 сут | M±m | 5,46 0,68 | 0,118* 0,003 | 0,085* 0,003 | 0,716* 0,008 | 25,6 2,12 | 0,99 0,08 | 46,2 6,15 | 2,12* 0,11 | 13,12 0,22 | 4,59* 0,23 |
| 6 сут | M±m | 5,08 0,80 | 0,135 0,007 | 0,104 0,007 | 0,778 0,007 | 40,8* 6,02 | 0,86 0,06 | 38,7 8,24 | 2,26 0,11 | 13,30 0,15 | 5,33 0,16 |
Условные обозначения к Табл.4.17:
У – минутный объем дыхания, л;
E О2 и E СО2 – потребление кислорода и выделение СО2 в минуту, л;
R3 – дыхательный коэффициент;
f – частота дыханий в минуту;
R4 – отношение времени выдоха ко времени вдоха;
УЕ – дыхательный эквивалент;
УА – альвеолярная вентиляция, л/мин;
P O2А и Р СО2А – парциальное давление кислорода или углекислоты в альвеолярном воздухе.
| Сроки исследования | Стат. Показ. | рН а | рН в | ВЕ | ВВ | SB | AB | ΣCO2 | Активность холинэстеразы цельной крови в % к исходной |
|---|---|---|---|---|---|---|---|---|---|
| Исходные данные | M±m | 7,359 0,007 | 7,317 0,007 | -2,74 0,31 | 42,3 0,86 | 21,9 0,26 | 21,8 0,24 | 23,0 0,25 | 100,0 - |
| 1 сут | M±m | 7,324* 0,004 | 7,293* 0,003 | -6,96* 0,24 | 38,5* 0,55 | 18,5* 0,16 | 17,9* 0,23 | 19,0* 0,24 | 105,2 17,6 |
| 3 сут | M±m | 7,324* 0,011 | 7,276 0,012 | -6,52 1,07 | 41,5 1,52 | 18,6 0,97 | 17,8 1,18 | 18,9 1,21 | 126,3 26,4 |
| 6 сут | M±m | 7,324 0,014 | 7,276 0,012 | -5,28 1,18 | 42,9 1,34 | 19,2 0,61 | 19,0 0,71 | 20,2 0,82 | 95,5 29,3 |
Условные обозначения к Табл.4.18.:
рН а и рН в - рН артериальной (а) и венозной (в) крови;
ВЕ – сдвиг буферных оснований, м-экв/л;
ВВ – содержание нормальных буферных оснований в крови, м-экв/л;
SB – величина стандартного биокарбоната крови, м-экв/л;
АВ – величина истинного биокарбоната крови, м-экв/л;
ΣCO2 – величина общей CO2 крови, , м-экв/л;
Как видно из приведенного в этих таблицах материала, на первые сут после применения указанных препаратов также отмечались снижение артерио-венозной разницы по кислороду, артериальная и венозная гипокапнемия, падал дыхательный коэффициент, однако степень выраженности таких изменений была меньшей.
Кроме того, Р50 крови с 4,14 кПа падало до 3,60 и 3,71 кПа соответственно на 1 и 3 сут. (Табл.4.16), что было меньшим, чем у не леченных животных. При исследовании кривых диссоциации оксигемоглобин также отмечается стабильный сдвиг ее влево, однако сдвига к низу верхнего ее отрезка не наблюдалось (Рис.4.8). Через 1 сут у животных этой ерии наблюдались явления субкомпенсированного метаболического ацидоза (Табл.4.18). Однако на 3 сут у большинства собак такие явления проходили.
Все леченные животные выжили. У них не отмечалось выраженной саливации, отсутствовала рвота, мало нарушалось общее состояние и не регистрировалась брадикардия.
Таким образом, использование в качестве лечебных средств «Никотинамида», «Кальция глюконата» и «Димедрола» позволяет быстро купировать нарушения в организме, обусловленные токсическим действием больших доз (передозировкой) Флараксина.
При наличии признаков ДВС-синдрома необходимо кроме перечисленных средств использовать соответствующие препараты («Гепарин», «Кортикал» и др.).
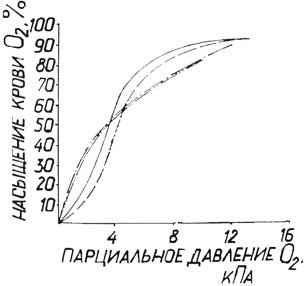 |
Условные обозначения:
Кривая диссоциации оксигемоглобина при Р СО2 5,33 кПа ( ______ до опыта; _._._._ через 1 сут)
Кривая диссоциации оксигемоглобина при Р СО2 8 кПа ( - - - - - до опыта; _.._.._.. через 1 сут)
Вывод.
Выраженные признаки передозировки Флараксина в эксперименте на собаках возникают при дозах препарата, во много (в 10) раз превышающих суточную терапевтическую. Для лечения таких отравлений необходимо использовать комплекс средств, оказывающих положительное влияние на тканевое дыхание («Никотинамид»), свертывание крови («Кальция глюконат»), обладающих антигистаминным действием («Димедрол»).
f. Фармакокинетические параметры Флараксина.
Опыты проведены на 50 белых половозрелых крысах, массой 180-220 г, содержавшихся на стандартном рационе вивария.
Изучение фармакокинетики Флараксина и/или его метаболитов в органах и тканях животных проводили с использованием метода радиоактивной индикации. Для этого к нерадиоактивному Флараксину добавляли радиоактивный, меченый по тритию в неопределенном положении (радиоактивный Флараксин был получен из Института ядерных исследований АН УССР).
Лекарственное средство вводили в хвостовую вену животных в дозе 35,0 мг/кг, активностью 50 млн. имп/мин (в 2 мл дистиллированной воды), и в течение 24 ч в динамике брали экскреты, органы и ткани животных и определяли их радиоактивность, используя метод (32) и методические рекомендации ((33,34). Для этого образцы проб подвергали щелочному гидролизу, нейтрализовали и вносили в виалы, содержащие диоксановый сцинтиллятор, этанол и метилцелло-зольв, после чего проводили радиометрию на жидкостном сцинтилляционном счетчике фирмы "ЛКБ-Приборы" (Швеция). Конечные результаты (содержание Флараксина и его метаболитов) выражали в мг/л – для плазмы крови и мочи, в мг/кг - для остальных органов и тканей, и кала.
Фармакокинетику лекарственного средства рассматривали: в плазме крови - в рамках одночастевой модели, в остальных органах и тканях и экскретах - в рамках одночастевой модели со всасыванием, используя соответствующие рекомендации (35,36). Математическую обработку данных проводили на ЭВМ "Искра - 1256". Различия между сериями опытов считали достоверными при Р≤0,05, используя критерий Стьюдента (37).
Проведенные исследования позволили установить, Флараксин, введенный внутривенно в дозе 35,0 мг/кг, активностью 50 млн. имп/мин, быстро и в значительных количествах поступает в органы и ткани крыс (табл.4.19).
Через 7,5 мин после введения в плазме крови животных определяется 10,31 мг/л лекарственного средства. В последующие сроки - 15-30 мин-1 ч - его содержание в плазме крови находится практически на одном уровне и регистрируется в пределах 9,93-9,19 мг/л. Через 2 ч после начала эксперимента уровень радиоактивности снижается в большей степени и составляет 8,71 мг/л, что на 16,0 % ниже по сравнению с начальным сроком. В дальнейшем, в период 4-8 ч, концентрация Флараксина и/или его метаболитов последовательно снижается до 7,61 и 5,83 мг/л, или, по отношению к начальному (7,5 мин) сроку исследования, на 26,0 и 34,0 % соответственно. К концу эксперимента (24 ч) уровень радиоактивности снижается до 2,26 мг/л.
В мозге крыс через 4 мин после введения определяется 6,75 мг/кг лекарственного средства. В последующие сроки - 15-30 мин его уровень возрастает и составляет 18,76 и 19,64 мг/кг соответственно. К 1 ч эксперимента содержание Флараксина и его метаболитов становится максимальным - 21,60 мг/кг. В период 2-4 ч уровень препарата находится в пределах 20,14-19,62 мг/кг, а к 8 и 24 ч снижается - до 16,33 и 9,80 мг/кг соответственно.
В глазах животных через 15 мин после введения содержится 11,09 мг/кг Флараксина и его метаболитов. Максимальное количество лекарственного средства определяется через 1 ч и составляет 25,57 мг/кг. В период 2-4-8 ч его уровень равен соответственно 22,24-20,25-20,62 мг/кг. К концу эксперимента (24 ч) содержание Флараксина и его метаболитов в тканях глаз снижается до 12,68 мг/кг.
| Стат. Показ. | Сроки исследования | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 4 мин | 7,5 мин | 15 мин | 30 мин | 1 ч | 2 ч | 4 ч | 8 ч | 24 ч | |
| Плазма крови | |||||||||
| M±m | - | 10,31 0,17 | 9,93 0,48 | 9,27 0,10 | 9,19 0,14 | 8,71 0,30 | 7,61 0,13 | 6,83 0,38 | 2,20 0,14 |
| Мозг | |||||||||
| M±m | 6,75 1,23 | 18,76 0,94 | 19,64 0,73 | 21,60 0,36 | 20,14 0,35 | 19,62 0,50 | 16,33 0,47 | 9,80 0,18 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +89,0 | +112,0 | +135,0 | +131,0 | +158,0 | +139,0 | +345,0 | ||
| Глаза | |||||||||
| M±m | 11,09 0,304 | 17,80 1,70 | 25,57 0,18 | 22,22 0,41 | 20,25 0,14 | 20,62 0,44 | 12,68 0,15 | ||
| Р | >0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +12,0 | +92,0 | +178,0 | +155,0 | +166,0 | +202,0 | +476,0 | ||
| Сердце | |||||||||
| M±m | 4,40 0,12 | 8,28 0,36 | 10,14 0,53 | 16,10 0,57 | 14,50 0,18 | 12,55 0,36 | 10,04 0,09 | 6,37 0,59 | |
| Р | <0,05 | >0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | -17,0 | +9,0 | +75,0 | +66,0 | +69,0 | +47,0 | +190,0 | ||
| Мышцы | |||||||||
| M±m | 6,50 0,53 | 15,0 0,11 | 23,0 0,91 | 21,57 0,91 | 17,42 0,28 | 17,0 1,10 | 14,16 1,14 | 11,99 0,14 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +51,0 | +148,00 | +135,0 | +100,0 | +123,0 | +107,0 | +445,0 | ||
| Кожа | |||||||||
| M±m | 15,47 0,10 | 22,63 0,22 | 24,10 0,57 | 19,86 0,68 | 19,38 0,25 | 20,54 0,14 | 11,79 0,39 | ||
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +56,0 | +144,0 | +162,0 | +128,0 | +155,0 | +201,0 | +436,0 | ||
| Слизистая оболочка тонкого кишечника | |||||||||
| M±m | 9,40 1,33 | 15,14 0,10 | 19,57 0,39 | 20,90 0,28 | 19,52 0,60 | 20,49 0,42 | 19,06 0,33 | 13,67 0,15 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +52,0 | +111,0 | +127,0 | +124,0 | +169,0 | +179,0 | +521,0 | ||
| Селезенка | |||||||||
| M±m | 6,76 0,26 | 11,47 0,23 | 14,70 0,92 | 23,98 0,69 | 19,25 0,16 | 14,67 0,42 | 19,06 0,33 | 13,67 0,15 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +16,0 | +59,0 | +161,0 | +121,0 | +93,0 | +59,0 | +183,0 | ||
| Печень | |||||||||
| M±m | 12,38 0,45 | 18,15 1,22 | 22,05 0,22 | 25,08 0,18 | 17,81 0,19 | 17,63 0,06 | 14,04 0,07 | 3,29 0,04 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +83,0 | +138,0 | +174,0 | +104,0 | +132,0 | +106,0 | +50,0 | ||
| Почки | |||||||||
| M±m | 6,99 0,07 | 10,25 0,22 | 14,81 0,05 | 21,70 1,02 | 17,30 0,09 | 13,40 0,08 | 7,89 0,06 | 6,57 0,07 | |
| Р | >0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | ||
| % изм. | +3,0 | +60,0 | +136,0 | +99,0 | +76,0 | +16,0 | +62,0 | ||
| Моча | |||||||||
| M±m | 15,0 0,42 | 16,19 0,51 | 17,25 2,51 | 17,45 1,40 | 19,08 0,28 | 24,90 854 | 16,37 0,62 | 9,54 0,38 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +45,0 | +63,0 | +86,0 | +90,0 | +119,0 | +227,0 | +140,0 | +334,0 | |
| Кал | |||||||||
| M±m | 1,82 0,152 | 3,53 0,03 | 4,62 0,21 | 5,35 0,04 | 8,06 0,39 | 7,12 0,19 | 6,98 0,14 | 4,83 0,34 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | >0,05 | >0,05 | >0,05 | <0,05 | |
| % изм. | -82,0 | -64,0 | -50,0 | -42,0 | -8,0 | -6,0 | +2,0 | +120,0 | |
Примечание к Табл.4.19: P и % изм. – различия по отношению к плазме крови.
В сердце через 4 мин после введения содержится 4,40 мг/кг Флараксина и его метаболитов. К 1 ч уровень лекарственного средства достигает максимальной величины –16,10 мг/кг. В последующие сроки отмечается прогрессирующее снижение его содержания с 14,50 (2 ч) до 12,55 (4 ч), 10,04 (8 ч) и 6,37 (24 ч) мг/кг.
В мышцах через 4 мин после начала эксперимента содержится 6,50 мг/кг лекарственного средства. Повышаясь в последующие сроки - 15-30 мин - уровень Флараксина и его метаболитов к 1 ч достигает максимума -21,57 мг/кг. К концу эксперимента содержание препарата снижается до 11,99 мг/кг.
B кожу через 15 мин после инъекции поступает 15,47 мг/кг Флараксина и его метаболитов. К 30 мин его уровень возрастает до 22,63 мг/кг, а к 1 ч - достигает максимальной величины, равной 24,10 мг/кг. Через 8 ч после начала эксперимента в коже регистрируется 20,54 мг/кг лекарственного средства. К 24 ч отмечено резкое двукратное, до 11,79 мг/кг, падение его уровня.
Через 4 мин после введения в слизистую оболочку тонкого кишечника поступает 9,40 мг/кг Флараксина и его метаболитов. В период 30 мин-8 ч уровень лекарственного средства находится в пределах 19,57-19,06 мг/кг, с максимумом, регистрируемым через 1 ч после начала эксперимента, равным 20,90 мг/кг. К 24 ч содержание препарата в слизистой оболочке тонкого кишечника снижается до 13,6 мг/кг.
В селезенке через 4 мин после начала эксперимента содержится 6,76 мг/кг лекарственного средства. В последующие сроки - 15-30 мин - уровень радиоактивности возрастает до 11,47-14,70 мг/кг. Через 1 ч после введения лекарственного средства в селезенке животных определяется его максимальное количество, равное 23,98 мг/кг. В последующие сроки отмечено прогрессирующее снижение содержания Флараксина и его метаболитов: с 19,25 (2 ч) до 14,67 (4 ч), 10,87 (8 ч) и 6,22 (24 ч) мг/кг.
Флараксина и его метаболиты активно поступают в печень животных - уже через 40 мин его содержание в этом органе равно 12,38 мг/кг. Как через 7,5, так и через 30 мин уровень лекарственного средства равен 18,15 мг/кг. К 1 ч эксперимента его содержание возрастает до 25,08 мг/кг, а в период 24ч равно 17,81-17,63 мг/кг. К концу эксперимента уровень Флараксина и его метаболитов падает до 3,29 мг/кг.
Через 4 мин после введения в почках крыс определяется 12,38 мг/кг лекарственного средства. К 15 мин его уровень возрастает до 10,25, а к 30 мин - до 14,81 мг/кг. Через 1 ч после начала эксперимента в ткани почек определяется максимальное содержание Флараксина и его метаболитов, равное 21,70 мг/кг. В последующие сроки уровень препарата изменяется следующим образом: снижается к 2 ч до 17,30; к 4 ч до 13,40; к 8 ч до 7,89; и к 24 ч до 3,57 мг/кг.
В моче через 7,5 мин определяется 15,0 мг/кг Флараксина и его метаболитов, а к 15,30 мин, 1, 2 ч его уровень возрастет соответственно до 16,19; 17,25; 17,45 и 19,08 мг/л. Максимальный уровень радиоактивности регистрируется в моче через 4 ч после начала эксперимента и составляет 24,9 мг/л. В дальнейшем происходит его резкое снижение до 16,30 мг/л (8 ч) и 9,54 мг/л (24 ч).
Менее активно Флараксин и его метаболиты выделяется с калом животных. Через 7,5 мин в кале определяется 1,82 мг/кг лекарственного средства. Постепенно возрастая, содержание Флараксина достигает своего максимума к 2 ч эксперимента и становится равной 8,06 мг/кг. Через 8 ч после введения в кале регистрируется 6,92 мг/кг Флараксина и его метаболитов, а в период 8-24 ч его уровень снижается до 4.83 мг/кг.
Сравнительный анализ показал, что во все сроки исследования содержание Флараксина и его метаболитов в изученных органах и тканях животных превышает уровень в плазме крови.
Таким образом, проведенные исследования позволили установить, что после внутривенного введения в дозе 35 мг/кг максимальное содержание Флараксина и его метаболитов в органах и тканях животных определяется через 1 ч после введения 3Н-Флараксина. Основной путь элиминации Флараксина и/или его метаболитов - почечный. При этом его максимальное количество в моче регистрируется через 4 ч после начала эксперимента.
Все вышеизложенное свидетельствует, что внутривенное введение Флараксина способствует его интенсивному, в значительных количествах, поступлению в органы и ткани животных.
Фармакокинетические константы для Флараксина и/или иго метаболитов в органах и тканях животных приведены в Табл.4.20.
| Стат. Показ. | Т1/2аб | Т1/2эл | У | С1 | S |
|---|---|---|---|---|---|
| Плазма крови | |||||
| M±m | 5,80 0,04 | 3,40 0,001 | 0,38 0,002 | 115,3 4,20 | |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| Мозг | |||||
| M±m | 0,14 0,06 | 16,90 0,70 | 1,42 0,320 | 0,06 0,009 | 588,7 81,30 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +191,0 | -58,0 | -84,0 | +411,0 | |
| Глаза | |||||
| M±m | 0,40 0,05 | 17,34 4,24 | 1,18 0,158 | 0,05 0,005 | 721,6 74,98 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +199,0 | -65,0 | -87,0 | +526,0 | |
| Сердце | |||||
| M±m | 0,13 0,01 | 21,47 2,27 | 2,55 0,002 | 0,08 0,009 | 424,6 45,20 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | -82,0 | -25,0 | -79,0 | +268,0 | |
| Мышцы | |||||
| M±m | 0,10 0,01 | 26,88 1,21 | 1,73 0,005 | 0,04 0,002 | 783,1 37,30 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +363,0 | -49,0 | -88,0 | +579,0 | |
| Кожа | |||||
| M±m | 0,09 0,01 | 27,50 1,33 | 1,58 0,014 | 0,04 0,002 | 379,2 45,11 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +374,0 | -54,0 | -89,0 | +663,0 | |
| Слизистая оболочка тонкого кишечника | |||||
| M±m | 0,06 0,002 | 44,7 1,62 | 1,72 0,004 | 0,03 0,001 | 1311,4 45,11 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +671,0 | -49,0 | -99,0 | +1037,0 | |
| Селезенка | |||||
| M±m | 0,18 0,02 | 12,21 0,88 | 1,71 0,550 | 0,11 0,027 | 343,7 77,70 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +111,0 | +68,0 | -72,0 | +198,0 | |
| Печень | |||||
| M±m | 0,06 0,005 | 8,68 0,04 | 1,52 0,009 | 0,12 0,001 | 287,5 3,27 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +50,0 | -55,0 | -68,0 | +149,0 | |
| Почки | |||||
| M±m | 0,12 0,01 | 9,80 0,12 | 2,03 0,040 | 0,14 0,002 | 243,9 2,60 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +69,0 | -40,0 | -63,0 | +111,0 | |
| Моча | |||||
| M±m | 2,80 0,02 | 9,90 0,04 | 1,70 0,001 | 0,12 0,002 | 375,0 68,0 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +71,0 | -50,0 | -68,0 | +225,0 | |
| Кал | |||||
| M±m | 1,30 0,01 | 21,60 0,05 | 5,30 0,005 | 0,16 0,008 | 278,2 59,5 |
| Р | <0,05 | <0,05 | <0,05 | <0,05 | |
| % изм. | +272,0 | +56,0/td> | -58,0 | +141,0 | |
Примечание к Табл.4.20: P и % изм. – различия по отношению к плазме крови.
Установлено, что Флараксин и/или его метаболиты, после внутривенного введения 3Н-Флараксина, быстро поступают в органы и ткани животных - период полуабсорбции равен 0,06 (слизистая оболочка тонкого кишечника)-0,40 ч (глаза). Для мочи этот показатель равен 2,80, для кала - 1,30 ч.
Лекарственное средство Флараксин при этом длительно циркулирует в кровяном русле животных - период полуэлиминации равен 5,80 ч, а также их органах и тканях, период полуэлиминации в которых возрастает, в сравнении с плазмой крови, на 50% (печень) -671 (слизистая оболочка тонкого кишечника).
Лекарственное средство Флараксин активно распределяется в органах и тканях животных. Его объем распределения в плазме крови равен 3,40 л/кг, что свидетельствует об активном выходе Флараксина и/или его метаболитов из кровяного русла. Для остальных органов и тканей этот показатель колеблется в пределах 1,18-2,55 л/кг.
Очищение плазмы крови животных от Флараксина и/или его метаболитов происходит интенсивно - клиренс равен 0,38 л/ч*кг. В остальных органах и тканях этот показатель на 63-99 % ниже.
Флараксин и/или его метаболиты в значительных количествах циркулирует в плазме крови животных - площадь под кривой "концентрация-время" равна 115,3 мг.ч/л. В то же время в остальных органах и тканях этот показатель значительно, в сравнении с плазмой крови, возрастает: на 111-198 % - в почках, печени, селезенке, на 268,0 % - в сердце, на 411-663 % - в мозге, глазах, мышцах, коже, на 1037,0 % - в слизистой оболочке тонкого кишечника. В моче и кале - на 225,0 и 141,0 % соответственно.
Таким образом, проведенные исследования позволили установить, что сразу же после внутривенного введения Флараксин быстро поступает и активно распределяется в организме животных. При этом лекарственное средство Флараксин и/или его метаболиты длительно и в больших количествах находятся в органах и тканях животных.
Элиминация лекарственного средства Флараксин и/или его метаболитов из организма животных осуществляется с мочой и калом в незначительных количествах.
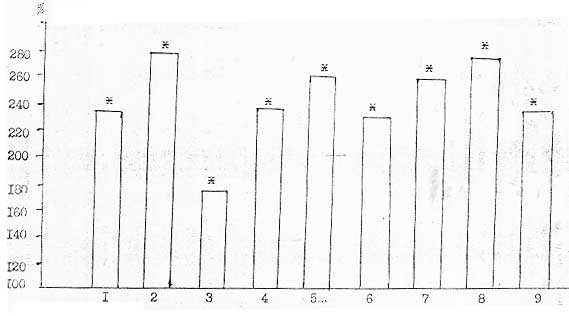 |
Примечание: * - различия между уровнем Флараксина и/или его метаболитов в плазме крови (100%) и органах и тканях животных достоверны при Р <0,05, 1-мозг, 2-глаза, 3-сердце, 4-мышцы, 5-кожа, 6-слизистая оболочка тонкого кишечника, 7-селезенка, 8-печень, 9-почки.
Заключение
- При изучении фармакокинетики 3H-Флараксина установлено, что после внутривенного введения в дозе 35 мг/кг это лекарственное средство быстро поступает в органы и ткани животных (период полуабсорбции находится в пределах 0,06-0,40 ч). При этом максимальное содержание Флараксина и/или его метаболитов в органах и тканях регистрируется через I ч после начала эксперимента.
- Флараксин и/или его метаболиты активно распределяется в организме животных - объем распределения в плазме крови равен 3,40 л/кг, успешно преодолевая гистогематические, гематоэнцефалический барьеры - максимальное содержание, регистрируемое в органах и тканях животных через 1 ч после начала эксперимента на 75-178% превышает соответствующий уровень в плазме крови.
- Длительная циркуляция Флараксина и/или его метаболитов в плазме крови (период полу элиминации равен 5.80 ч) обеспечивает его постоянное поступление в органы и ткани животных, период полу элиминации в которых более высок.
- Площади под кривой "концентрация-время" в органах и тканях животных можно расположить в следующей последовательности (в порядке возрастания): плазма крови < почки < печень < селезенка < сердце < мозг < глаза < мышцы < кожа < слизистая оболочка тонкого кишечника. Это свидетельствует, что Флараксин и/или его метаболиты наименее активно поступает в почки и печень, наиболее - в кожу и слизистую оболочку тонкого кишечника.
- Экскретируется Флараксин и/или его метаболиты с мочой и калом: площадь под кривой "концентрация-время" в моче равна 375,0, для кала - 278,2 мг.ч./л.
Таким образом, проведенные исследования позволили установить, что внутривенное введение Флараксина в дозе 35 мг/кг способствует его активному поступлению в органы и ткани животных. При этом лекарственное средство Флараксин и/или его метаболиты длительно находится в кровяном русле, органах и тканях животных, активно распределяясь в них. Основной путь экскреции - почечный.
Выводы
- Флараксин взаимодействует с ЧСА и цитохромом-С с участием тирозиновых и триптофановых остатков. Применение 5% глюкозы на порядок ингибирует реакцию ЧСА с ФЛАРАКСИНОМ, способствует возрастанию скорости взаимодействия с тирозиновыми и ингибированию взаимодействия с триптофановыми остатками.
- Острая токсичность ФЛАРАКСИНА при внутривенном введении крысам в 4-5 раз меньше таковой у вещества-основы ФЛАРАКСИНА.
- Флараксин является малокумулирующим веществом и не изменяет массу тела, печени и селезенки мышей.
- Флараксин обладает антиоксидантным эффектом, что проявляется повышением выживаемости животных, отравленных тетрахлорметаном. Антиоксидантные свойства ФЛАРАКСИНА в условиях in vitro проявляются в большей степени, чем у α -токоферола.
- Флараксин в дозе 10 мг/кг внутримышечно, в течение 6-15 сут до иммунизации не оказывает отрицательного влияния на показатели гуморального и клеточного звеньев иммунологической реактивности организма.
- Выраженные признаки передозировки ФЛАРАКСИНА в эксперименте на собаках возникают при дозах препарата, в 40 раз превышающих суточную терапевтическую. Для лечения таких отравлений необходимо использовать комплекс средств, оказывающих положительное влияние на тканевое дыхание (никотинамид), сосуды (кальция глюконат), обладающих антигистаминным действием (димедрол).
- При внутривенном введении крысам ФЛАРАКСИН активно распределяется в организме животных (объем распределения в плазме крови равен 3,40 л/кг). Максимальное содержание лекарственного средства в органах и тканях животных определяется через 1 ч после введения и на 75-178 % превышает уровень в плазме крови, равный 9,19 мг/л.
Зам. Директора по научной работе
Док-р.м.н., профессор - Ю.И.Губский
Руководители темы:
Член-корр. АН Украины, профессор - И.С.Чекман
Док-р мед.наук – Ю.Н.Максимов
Ответственные исполнители:
Канд.мед.наук, ст.н.с. – Т.И.Григрьева
Канд.мед.наук, ст.н.с. – И.А.Кулик

